
【题目】为除去KCl溶液中含有的少量K2SO4和CaCl2,下列各操作:①加热蒸发;②加过量BaCl2溶液;③加适量盐酸;④加过量K2CO3;⑤过滤。顺序正确的是 ( )
A. ②③④⑤① B. ②④⑤③① C. ①②③④⑤ D. ④③②⑤①
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列关于某物质是否为电解质的判断正确的是
A. 固体氯化钠不导电,所以氯化钠不是电解质
B. 氯化氢水溶液能导电,所以氯化氢是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. 氨水能导电,所以氨水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:___________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。要除去该物质,可先在混合液中加入________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)写出①中正极的电极反应式:___________。
(2)②中负极材料为_______,总反应的离子方程式为___________ 。
(3)甲、乙两同学都认为“如果构成原电池的电极材料都是金属,则作负极的金属应比作正极的金属活泼”,则甲同学得出的结论是_______的活动性更强,乙同学得出的结论是______的活动性更强。(填元素符号)
(4)由该实验得出的下列结论中,正确的是________(填字母)。
A.利用原电池反应判断金属活动性强弱时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气。这两类燃料的主机成分是( )
A.碳水化合物 B.碳氢化合物 C.氢气 D.醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子质量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图所示的关系。
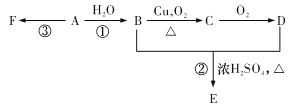
(1)A的分子式为________。
(2)写出反应①的化学方程式________;该反应的类型是________。写出反应③的化学方程式________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为________。
(4)标准状况下,将A与某烃混合共11.2L,该混合烃在足量的氧气中充分燃烧,生成CO2的体积为17.92L,生成H2O18.0g,则该烃的结构式为________;A与该烃的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述不正确的是
①任何可逆反应都有一定的限度;
②化学反应的限度是不可改变的;
③化学反应的限度与时间的长短无关;
④化学反应达到限度时,正逆反应的速率相等;
⑤达到平衡时,反应停止了,正、逆反应速率都为零。
A. ①④ B. ②⑤ C. ②③ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用如图所示的原电池装置做电源电解足量的NaC1的酚酞溶液,X、Y均为惰性电极。下列有关说法不正确的是
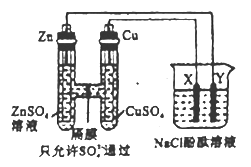
A. 原电池中SO42-通过隔膜从左向右移动
B. 反应一段时间后,烧杯中Y电极附近变红
C. Zn极质量减少6.5g时,X极理论上生成气体2.24L(标准状况)
D. 室温下,若Cu极质量增加1.6g时,此时烧杯溶液体积为500mL,则溶液的pH为13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com