
| A、用0.2000 mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol?L-1 ),至中性时,溶液中的酸未被完全中和 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| D、相同温度下,将足量氯化银固体分别放入相同体积的 ①蒸馏水; ②0.1 mol?L-1 盐酸; ③0.1 mol?L-1 氯化镁溶液; ④0.1 mol?L-1 硝酸银溶液中;Ag+浓度:①>④=②>③ |
| 1 |
| 10 |


科目:高中化学 来源: 题型:
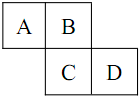 短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:
短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
| B、20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) |
| D、0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b>a>d>c |
| B、b>a=d>c |
| C、a=b>c>d |
| D、c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(NO2) | 0.00 | 0.48 | b | 1.04 | 1.2 | 1.2 |
| n(N2O4) | 0.80 | a | 0.40 | c | d | e |
| A、该反应的方程式为2NO2?N2O4 |
| B、80s前该反应一定没有达到平衡状态 |
| C、a的取值为0.56 |
| D、20s到40s内用N2O4表示的反应速率为0.010mol?L-1?S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
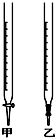 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 甲 |
| B | 碱 | 酸 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 甲基橙 | 甲 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
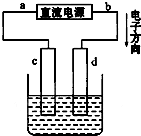 如图是电解饱和NaCl溶液的实验装置,其中c、d为石墨电极.则下列有关判断中正确的是( )
如图是电解饱和NaCl溶液的实验装置,其中c、d为石墨电极.则下列有关判断中正确的是( )| A、a为正极、b为负极 |
| B、c为阴极、a为阳极 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com