
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
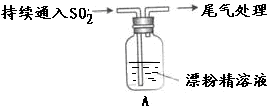 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
分析 (1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;
(2)由现象可知,次氯酸钙与二氧化硫发生氧化还原反应,液面上方出现白雾,白雾中含有HCl,溶液中含氯离子
①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(3)A瓶中混合物过滤、洗涤,得到沉淀X,X为CaSO4,与盐酸不反应,与氯化钡反应生成硫酸钡沉淀;氯气与二氧化硫可发生氧化还原反应
①A瓶中混合物过滤、洗涤得沉淀X,向X中加入稀HC1,无明显变化,不含CaSO3.取上层清液,加入BaC12溶液,产生白色沉淀,说明有SO42-.故X中含有的物质是CaSO4;
②iii中黄绿色褪去的原因是SO2还原了Cl2的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(4)由3ClO-+I-=3Cl-+IO3- ①、IO3-+5I-+3H2O=6OH-+3I2②可知,
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2,由滴定实验可知,消耗KI溶液的体积为(19.98+20.02+20.00)mL×$\frac{1}{3}$=20.00mL,
先计算次氯酸钙的质量,再根据质量分数公式计算;
解答 解:(1)Cl2和Ca(OH)2反应生成氯化钙、次氯酸钙和水,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)由现象可知,次氯酸钙与二氧化硫发生氧化还原反应,液面上方出现白雾,白雾中含有HCl,溶液中含氯离子,则
a.用湿润的碘化钾淀粉试纸检验白雾,无变化,则没有氯气生成;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀,沉淀可能为AgCl,也可能为Ag2SO4或Ag2SO3,
①实验a目的是验证Cl2是否存在,
故答案为:验证Cl2是否存在;
②由实验a、b不能判断白雾中含有HC1,理由是与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3,
故答案为:与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3;
(3)①CaSO4与盐酸不反应,与氯化钡反应生成硫酸钡沉淀,则则沉淀X中含有的物质是CaSO4,
故答案为:CaSO4;
②氯气与二氧化硫可发生氧化还原反应,黄绿色褪去,则离子方程式解释现象iii中黄绿色褪去的原因为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(4)由3ClO-+I-=3Cl-+IO3- ①、IO3-+5I-+3H2O=6OH-+3I2②可知,
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2,由滴定实验可知,消耗KI溶液的体积为(19.98+20.02+20.00)mL×$\frac{1}{3}$=20.00mL,
设次氯酸根离子的物质的量为x,
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.2000mol•L-1×0.020L
所以x=0.002mol,
次氯酸钙的质量为:143g/mol×$\frac{1}{2}$×0.002mol=0.143g,
该漂白粉中有效成分的质量分数为 $\frac{0.143g}{2.000g}$×100%=7.15%,
故答案为:7.15%.
点评 本题考查较综合,涉及性质实验方案的设计、物质含量的测定等,把握反应原理及实验中现象分析、含量计算的关系式为解答的关键,侧重分析能力、实验能力、计算能力的综合考查,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y的空间构型为V形.
,Y的空间构型为V形.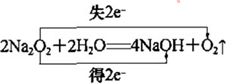 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
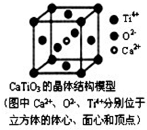 下列关于晶体的说法正确的组合是( )
下列关于晶体的说法正确的组合是( )| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑦ | D. | ③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com