
下列说法中正确的是 ( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.分子中一定含有化学键
D.含有金属元素的离子一定是阳离子
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【化学卷·2015届浙江省嘉兴市高三上学期学科基础测试(201409)】8. 下列说法正确的是
A.石油裂解的目的是为了提高汽油等轻质油的产量和质量
B.等质量的葡萄糖和淀粉燃烧消耗的氧气量相等
C.用溴水可鉴别乙醇、环已烯和甲苯
D.分别用乙烷和乙烯制备氯乙烷的反应类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)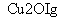
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN-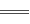 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
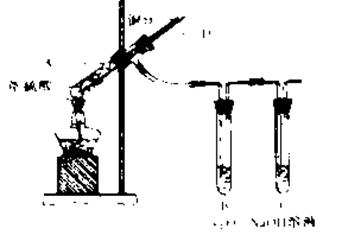
实验步骤:
①先连接好装置,检查气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____________________.
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_________________.
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点___________,(填“同意”或“不同意”),说明理由_________(用离子方程式表示)。
II、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
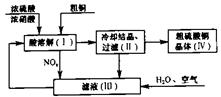
回答下列问题:
(4)配平在滤液(III)中发生反应的化学方程式:
_____NOx+____H2O+___O2=____HNO3
(5)写出制取硫酸铜的总反应方程式:_______________________.
(6)在上述生产过程中,被循环使用的物质是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3的说法不正确的是 ( )
2SO3的说法不正确的是 ( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,完成以下有关问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:
① ;⑥ ;⑦ ;⑪ 。
(2)在这些元素中,最活泼的金属元素是 ;最活泼的非金属元素是 ;最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ;碱性最强的是 ;呈两性的氢氧化物是 ;写出三者之间相互反应的化学方程式
;
;
。
(4)在这些元素中,原子半径最小的是 ;原子半径最大的是 。
(5)④和⑧形成的化合物中含有的化学键类型是 ;其电子式为 。
(6)在⑧和⑫中,非金属性较强的是 ;写出能体现非金属性强弱的一个化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)表中原子半径最小的元素符号是 ;
(2)表中氧化性最强的单质的化学式为 ;
(3)表中最高价氧化物的水化物中碱性最强的物质的化学式是 ,酸性最强的物质的化学式是________________________________;
(4)④⑤⑥三种元素中,离子半径大小的顺序为 > >
(填离子符号);
(5)③⑦⑧三种元素的气态氢化物的稳定性强弱顺序为 >
> (填化学式);
(6)元素②的氢化物与元素⑧的氢化物反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在用锌片、铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法中正确的是 ( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中H2SO4的物质的量减少
D.电解液的pH保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com