
某工业废水中可能含有如下几种阴阳离子:
阳离子 Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子 Cl﹣、CO32﹣、NO3﹣、SO42﹣、SiO32﹣
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成.过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成.
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X).若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al+ X+ 7 OH﹣= AlO2﹣+ NH3+ N2+ 2H2O ,该反应的还原产物是 .若除去0.2molX离子,要消耗铝 g.
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10﹣2mol•L﹣1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 .(已知常温下Fe(OH)3的Ksp=1.0×10﹣38)
考点: 常见离子的检验方法;氧化还原反应;难溶电解质的溶解平衡及沉淀转化的本质.
专题: 氧化还原反应专题;离子反应专题;电离平衡与溶液的pH专题.
分析: Ⅰ.取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,即为二氧化氮,那么一定含有NO3﹣和Fe2+;
Ⅱ.向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,那么溶液中一定含有:SO42﹣,那么原溶液中一定不含有:Ba2+,生成的沉淀是硫酸钡;
Ⅲ.向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,不能确定原溶液中是否含有:Fe3+,因为亚铁离子被硝酸氧化生成铁离子;过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32﹣和SiO32﹣,据此解答各小题即可.
解答: 解:Ⅰ.取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,即为二氧化氮,那么一定含有NO3﹣和Fe2+;
Ⅱ.向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,那么溶液中一定含有:SO42﹣,那么原溶液中一定不含有:Ba2+,生成的沉淀是硫酸钡;
Ⅲ.向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,不能确定原溶液中是否含有:Fe3+,因为亚铁离子被硝酸氧化生成铁离子;过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32﹣和SiO32﹣,
(1)依据分析可知:该废水中一定含有的阴离子是:NO3﹣ SO42﹣; 一定不含有的阳离子是:Ba2+,故答案为:NO3﹣、SO42﹣;Ba2+;
偏铝酸根与碳酸生成氢氧化铝沉淀,离子反应方程式为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣,故答案为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;
(3)在此反应中Al化合价由0价升高为+3价,N元素被还原为氨气和氮气,且体积比为1:4,根据元素守恒得到X应为NO3﹣;反应前有氢元素,根据元素守恒得到反应后也应该有氢元素,故产物中还有H2O;根据化合价升降相等可以得到此反应.分析本反应中的化合价的变化可以看到氮元素化合价降低即还原产物为NH3 和 N2;根据反应16Al+9NO3﹣+7OH﹣=16AlO2﹣+NH3↑+4N2↑+2H2O
16mol 9mol
n(Al) 0.2mol,n(Al)=16×0.2/9mol,故m(Al)=9.6g,
故答案为:16、9、7、16、1、4、2 H2O;NH3、N2; 9.6g;
(4)Ksp=1.0×10﹣38=c(Fe3+)×c3(OH﹣),c(Fe3+)=1.0×10﹣2mol•L﹣1,故c (OH﹣)=1.0×10﹣12 mol•L﹣1,又KW=1.0×10﹣14,故c (H+)=1.0×10﹣2 mol•L﹣1,pH=2,故将Fe3+转换为Fe(OH)3沉调节溶液pH至少大于2,故答案为:2.
点评: 本题主要考查的是常见阳离子与阴离子的检验,涉及知识点:氧化还原反应方程式的配平,溶度积常数的计算等,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
分子式为C5H7Cl的有机物,其结构不可能是( )
|
| A. | 只含有1个双键的直链有机物 |
|
| B. | 含2个双键的直链有机物 |
|
| C. | 含1个双键的环状有机物 |
|
| D. | 含一个三键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
食品香精菠萝酯的生产路线(反应条件略去)如图所示,下列叙述错误的是( )
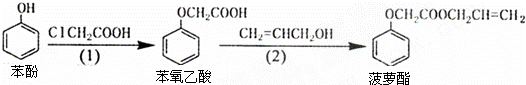
A. 步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B. 步骤(2)产物中残留的烯丙醇可用溴水检验
C. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D. 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2﹣、CO32﹣、SiO32﹣、Cl﹣中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成.
②另取少量原溶液,逐滴加入5mL0.2mol•L﹣1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、A13+、SiO32﹣、Cl﹣
B. 该溶液中一定含有K+、AlO2﹣、CO32﹣、Cl﹣
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42﹣、NO3﹣、Cl﹣中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
A. 该溶液中所含的离子是:Fe2+、Na+、SO42﹣、NO3﹣
B. 若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色
C. 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色
D. 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、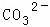 、
、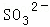 、
、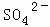 、Cl﹣、
、Cl﹣、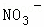 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:
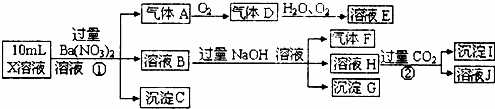
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 .
沉淀G的化学式为.
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是()
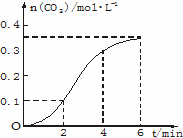
A. 反应开始4 min内温度对反应速率的影响比浓度小
B. 反应4 min后平均反应速率最小
C. 反应开始2 min内平均反应速率最大
D. 反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1•(L•min)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.将钠放入水中,钠将沉在水底
B.将一小块钠放在稀盐酸中,钠将与水反应生成NaOH和H2,生成的NaOH再与HCl反应生成NaCl和H2O
C.将一小块钠放在CuSO4溶液中发生如下反应:2Na+CuSO4═Na2SO4+Cu
D.Na2O和Na2O2中,氧元素化合价不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com