
高温下,某反应达平衡,平衡常数 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O CO2 + H2
CO2 + H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年宁夏银川九中高三上学期期中化学试卷(解析版) 题型:填空题
(14分)(1)已知:Fe(s)+ O2(g)=FeO(s) △H=-272.0kJ?mol-1
O2(g)=FeO(s) △H=-272.0kJ?mol-1
2Al(s)+ O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
下列分散系中的分散质的粒子大小属于纳米级(1~100 nm)的是
A.Fe(OH)3胶体 B.Fe(OH)3沉淀
C.FeCl3溶液 D.碘水与CCl4溶液振荡后的混合液
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
下列物质中含有自由移动 的是
的是
A.氯酸钾固体 B.液氯 C.氯化氢气体 D.氯化钾溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:填空题
(18分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
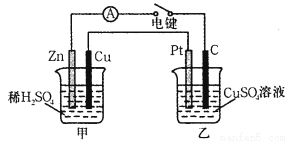
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极 ;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为 。(用NA表示)
(Ⅱ)由Cu2+、Cl- 、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为 。
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
关于如图所示装置的叙述,正确的是

A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液,又产生黄色沉淀。有关下列说法正确的是
A.产生的淡黄色沉淀为AgI
B.产生的黄色沉淀为AgBr
C.由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl)
D.上述实验现象说明沉淀可相互转化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
a mol FeS与b mol FeO投入到V L c mol·L-1的硝酸溶液中,恰好完全反应,还原产物只有NO,所得澄清溶液可看作是Fe(NO3)3与H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g
③(a+b)mol ④(Vc— )mol
)mol
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列各组离子,能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、Na+、MnO4-、OH-
②使pH试纸变深蓝色的溶液中: K+、CO32-、Na+、AlO2-
③水电离的c(H+)=1.0×10-12mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、Cl-、SO32-
A.①③ B.②④⑤ C.①②⑤ D.③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com