
分析 (1)一份向混合溶液中加入过量BaCl2溶液,发生反应SO42-+Ba2+=BaSO4 ↓,充分反应后得沉淀2.33g为BaSO4的质量,利用硫酸根守恒计算计算硫酸的物质的量;
(2)另一份混合溶液中加入100mL 1.0 mol•L-1NaOH溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,根据硫酸的物质的量计算消耗NaOH的物质的量,再根据H原子守恒计算盐酸浓度.
解答 (1)n(BaSO4 )=$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根离子守恒得n(H2SO4)=n(BaSO4 )=0.01mol,故答案为:0.01;
(2)另一份混合溶液中加入100mL 1.0 mol•L-1NaOH溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,根据方程式知,硫酸消耗的n(NaOH)=2n(H2SO4)=2×0.01mol=0.02mol,混合溶液中H+浓度为0.1mol•L-1、溶液的体积为200mL,则剩余n(HCl)=0.1mol/L×0.2L=0.02mol,则与NaOH溶液反应的n(HCl)=n(NaOH)(余下)=1.0mol/L×0.1L-0.02mol=0.08mol,则总的n(HCl)=0.02mol+0.08mol=0.1mol,其浓度=$\frac{0.1mol}{0.1L}$=1mol/L,故答案为:1.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析、计算能力,明确发生的反应及各个物理量之间的关系式是解本题关键,注意每一份溶液体积是100mL而不是200mL,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
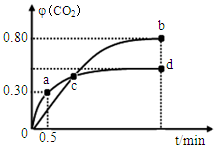 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).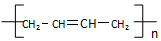 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: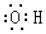 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com