
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
分析 NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强;碳酸氢钠受热分解生成碳酸钠好、二氧化碳和水;
(1)加入氯化钡溶液后,如生成沉淀,说明乙同学结论正确;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解.
解答 解:NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强,碳酸氢钠分解反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:HCO3-+H2O?H2CO3+OH-;大于;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(1)加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,乙同学结论正确,而加入A、D都生成沉淀,不能正确,加入C无现象,
故答案为:乙;B;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解,则甲正确,
故答案为:甲.
点评 本题考查较为综合,涉及盐类的水解和实验方案的评价,侧重于学生的实验能力和评价能力的考查,注意把握盐类水解的原理和规律,把握物质的性质,难度不大.


科目:高中化学 来源: 题型:实验题
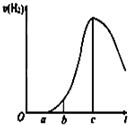 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取氨气 制取氨气 | |
| B. |  可用于制备氢氧化亚铁并观察其颜色 可用于制备氢氧化亚铁并观察其颜色 | |
| C. |  X若为四氯化碳,可用于吸收氨气,并防止倒吸 X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. |  原电池,锌电极为负极,发生还原反应 原电池,锌电极为负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 具有酸性,可以与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
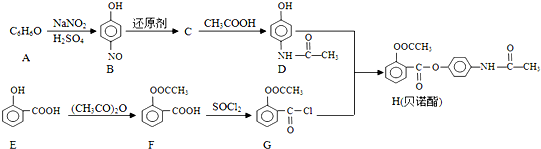
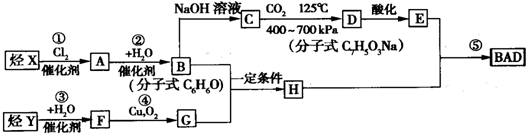
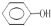 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基.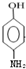 .
.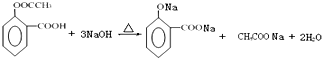 .
.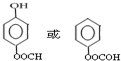 .
.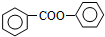 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):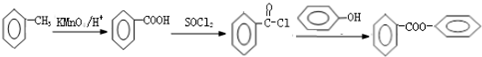 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

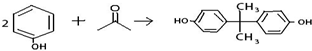
 .
. ;
;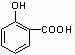 +
+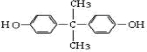 →
→ +2H2O.(不须写反应条件)
+2H2O.(不须写反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
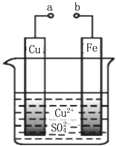
| A. | a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池 | |
| B. | a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成 | |
| D. | a和b用导线连接时,溶液中的Cu2+应向铜电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com