
分析 某无色透明溶液中可能大量存在H+、Ag+、Mg2+、Cu2+中的几种离子,一定不存在Cu2+离子,取少量溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明一定含Ag+,取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是Mg2+,原溶液中银离子也会和氢氧根离子反应生成白色沉淀,氢离子可以利用指示剂检验其存在,溶液中银离子大量共存,阴离子和H+、Ag+、Mg2+不能反应,据此分析判断.
解答 解:某无色透明溶液中可能大量存在H+、Ag+、Mg2+、Cu2+中的几种离子,一定不存在Cu2+离子,取少量溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明一定含Ag+,取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是Mg2+,原溶液中银离子也会和氢氧根离子反应生成白色沉淀,氢离子可以利用指示剂检验其存在,溶液中银离子大量共存,阴离子和H+、Ag+、Mg2+不能反应,据此分析判断,
(1)不做任何实验就可以肯定溶液中不存在的离子是铜离子,在无色溶液中不能存在蓝色的铜离子,
故答案为:Cu2+;
(2)取少量溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是Ag+,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag+;Ag++Cl-=AgCl↓;
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是Mg2+,该步实验取(2)的滤液而不是直接取原溶液的原因是原溶液中银离子也会和氢氧根离子反应生成白色沉淀,排除Ag+对Mg2+鉴别的干扰,
故答案为:Mg2+;排除Ag+对Mg2+鉴别的干扰.
(4)检验溶液中是否存在大量H+的方法是利用氢离子的酸性,取样,滴加紫色石蕊试液,若溶液变成红色,说明有H+存在,
故答案为:取样,滴加紫色石蕊试液,若溶液变成红色,说明有H+存在;
(5)原溶液中可能大量存在的阴离子不能和一定存在的阳离子发生反应,
a.Cl- 和银离子结合生成白色沉淀,故a错误;
b.NO3- 和 H+、Ag+、Mg2+不发生反应,可以大量共存,故b正确;
c.CO32- 和 H+、Ag+、Mg2+发生反应不能大量共存,故c错误;
d.OH-和H+、Ag+、Mg2+发生反应不能大量共存,故d错误,
故答案为:b.
点评 本题主要考查的是离子的检验,根据离子的颜色、离子之间的反应来分析解答,知道常见离子的检验方法及现象,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 6:3:1 | B. | 9:6:1 | C. | 13:6:1 | D. | 26:192:71 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2、Na2SO4、K2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、Na2SO4、K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
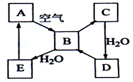 如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价为+6 | |
| B. | 元素原子的最外层只有一个电子 | |
| C. | 原子核外各电子层的电子数均达到饱和 | |
| D. | 其最高价氧化物溶于水是强酸,且有气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com