
(14��)��������Ի����Ѻã����ʶ������к���Ҫ���о���Ӧ�ü�ֵ��
��1��ʵ�������÷�Ӧ ���Ʊ�������
���Ʊ�������
��ȡ�����ʵ���Ũ�ȵ���� ��Һ�ֱ��������ʵ�飬�о���������Ը÷�Ӧ���ʵ�Ӱ�죬ʵ�鱨�����±���ʾ��
��Һ�ֱ��������ʵ�飬�о���������Ը÷�Ӧ���ʵ�Ӱ�죬ʵ�鱨�����±���ʾ��
|
��� |
���� |
���� |
���� |
|
|
1 |
�¶�/�� |
���� |
||
|
2 |
40 |
FeCl3��Һ |
|
|
|
3 |
20 |
FeCl3��Һ |
|
|
|
4 |
20 |
MnO2 |
|
|
|
5 |
20 |
�� |
|
|
ʵ��1��2�о����� ��H2O2�ֽ����ʵ�Ӱ�졣
ʵ��2��3��Ŀ���� ��
ʵ���п��Ա����÷�Ӧ���ʲ���������� ��
��ʵ������MnO2���÷�Ӧ�Ĵ�����ʹ������ͼ��ʾװ�õ�A�����Ʊ�O2�����ⷴӦ���ھ��ҵIJ����� ��

��2��Na2O2��ˮ��ӦҲ������O2��ijͬѧȡ4 g Na2O2��Ʒ�����ˮ��Ӧ������Ӧ��ȫ��ֹʱ����100 mL��ҺX��448 mL O2(������Ϊ��״��)����ͬѧ�Ʋ���Ʒ�к������ʻ�Ӧ������H2O2��������ʵ���о���
��ȡ����X���Թ��У��μ�FeCl2��Һ���������ɺ��ɫ��������Ӧ�����ӷ���ʽ�� ��
��ͨ������ͼ��ʾ����ʵ��װ�òⶨNa2O2��Ʒ�Ĵ��ȣ������������ʲ��μӷ�Ӧ��ȡ25 mL X��������ƿ��ʹ�������KMnO4������Һ��Ӧ����������56 mL O2(������Ϊ��״��)�������Ʒ�У�Na2O2������������ ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(14��)��������Ի����Ѻã����ʶ������к���Ҫ���о���Ӧ�ü�ֵ��
��1��ʵ�������÷�Ӧ���Ʊ�������
��ȡ�����ʵ���Ũ�ȵ������Һ�ֱ��������ʵ�飬�о���������Ը÷�Ӧ���ʵ�Ӱ�죬ʵ�鱨�����±���ʾ��
| ��� | ���� | ���� | ���� | |
| 1 | �¶�/�� | ���� | ||
| 2 | 40 | FeCl3��Һ |
|
|
| 3 | 20 | FeCl3��Һ |
|
|
| 4 | 20 | MnO2 |
|
|
| 5 | 20 | �� |
|
|
ʵ��1��2�о����� ��H2O2�ֽ����ʵ�Ӱ�졣
ʵ��2��3��Ŀ���� ��
ʵ���п��Ա����÷�Ӧ���ʲ���������� ��
��ʵ������MnO2���÷�Ӧ�Ĵ�����ʹ������ͼ��ʾװ�õ�A�����Ʊ�O2�����ⷴӦ���ھ��ҵIJ����� ��
��2��Na2O2��ˮ��ӦҲ������O2��ijͬѧȡ4 g Na2O2��Ʒ�����ˮ��Ӧ������Ӧ��ȫ��ֹʱ����100 mL��ҺX��448 mL O2(������Ϊ��״��)����ͬѧ�Ʋ���Ʒ�к������ʻ�Ӧ������H2O2��������ʵ���о���
��ȡ����X���Թ��У��μ�FeCl2��Һ���������ɺ��ɫ��������Ӧ�����ӷ���ʽ�� ��
��ͨ������ͼ��ʾ����ʵ��װ�òⶨNa2O2��Ʒ�Ĵ��ȣ������������ʲ��μӷ�Ӧ��ȡ25 mL X��������ƿ��ʹ�������KMnO4������Һ��Ӧ����������56 mL O2(������Ϊ��״��)�������Ʒ�У�Na2O2������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�γ���������ѧ������ѧ��ѧ����п��Ի�ѧ�Ծ����������� ���ͣ������
(14 ��)��������ͳ������dz�������ɫ���������ڹ�ҵ������������Ҫ����;��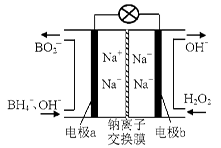
��1���ݱ��������⻯����NaBH4��B�Ļ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϵ�ȼ�ϵ�أ�������ͨ�����ǵ�Դ���������ϲ���Pt/C���������ϲ���MnO2���乤��ԭ������ͼ��ʾ���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ�� ��
��MnO2���������ϣ���������Ϊ ��
��2��������䳣��Һ̬�£�N2H4��Ϊȼ�ϣ�Һ̬��������
Ϊ��ȼ������֪��
N2H4(g) + O2(g) �� N2(g) + 2H2O(g) ��H =" �C" 534 kJ��mol-1
H2O2(l) = H2O(l) + 1/2O2(g) ��H =" �C" 98.64 kJ��mol-1
H2O(l) = H2O(g) ��H=" +" 44kJ��mol-1
��ӦN2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) �ġ�H= ��
��3��O3 ���ɳ�����������ԭ������ͼ��ʾ�����ϡ�����Ƶá�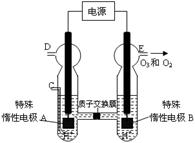
�� ͼ������Ϊ ���A����B������
����C��ͨ��O 2����A���ĵ缫��ӦʽΪ�� ��
����C����ͨ��O 2 ��D��E���ֱ��ռ���15.68L����6.72L���壨��״���£�����E���ռ���������O2��O3�����֮��Ϊ ������ O 3 �ķֽ⣩��
��4������O3����������ȼú�����е�NOx��SO2�ѳ�Ч����������¯�����е�NOx ��������NO��ʽ���ڵģ��ɷ�����ӦNO(g��+ O3 (g)
��������NO��ʽ���ڵģ��ɷ�����ӦNO(g��+ O3 (g)  NO2(g)+ O2 (g)����һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵����
NO2(g)+ O2 (g)����һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵���� 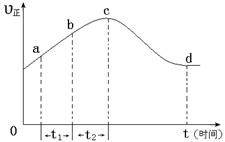
a����Ӧ��c��ﵽƽ��״̬
b����Ӧ��Ũ�ȣ�b��С��c��
c���÷�ӦΪ���ȷ�Ӧ
d����t1����t2ʱ��NO��ת������a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�γ��и�����ѧ��ѧ����п��Ի�ѧ�Ծ��������棩 ���ͣ������
(14 ��)��������ͳ������dz�������ɫ���������ڹ�ҵ������������Ҫ����;��
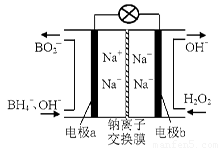
��1���ݱ��������⻯����NaBH4��B�Ļ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϵ�ȼ�ϵ�أ�������ͨ�����ǵ�Դ���������ϲ���Pt/C���������ϲ���MnO2���乤��ԭ������ͼ��ʾ���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ�� ��
��MnO2���������ϣ���������Ϊ ��
��2��������䳣��Һ̬�£�N2H4��Ϊȼ�ϣ�Һ̬��������
Ϊ��ȼ������֪��
N2H4(g) + O2(g) �� N2(g) + 2H2O(g) ��H =" �C" 534 kJ��mol-1
H2O2(l) = H2O(l) + 1/2O2(g) ��H =" �C" 98.64 kJ��mol-1
H2O(l) = H2O(g) ��H=" +" 44kJ��mol-1
��ӦN2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) �ġ�H= ��
��3��O3 ���ɳ�����������ԭ������ͼ��ʾ�����ϡ�����Ƶá�
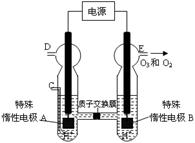
�� ͼ������Ϊ ���A����B������
����C��ͨ��O 2����A���ĵ缫��ӦʽΪ�� ��
����C����ͨ��O 2 ��D��E���ֱ��ռ���15.68L����6.72L���壨��״���£�����E���ռ���������O2��O3�����֮��Ϊ ������ O 3 �ķֽ⣩��
��4������O3����������ȼú�����е�NOx��SO2�ѳ�Ч����������¯�����е�NOx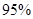 ��������NO��ʽ���ڵģ��ɷ�����ӦNO(g��+ O3 (g)
��������NO��ʽ���ڵģ��ɷ�����ӦNO(g��+ O3 (g)  NO2(g)+ O2 (g)����һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵����
NO2(g)+ O2 (g)����һ�������£���NO��O3ͨ����Ⱥ����ܱ������з���������Ӧ ������Ӧ������ʱ��仯��ʾ��ͼ������ͼ����ʾ����ͼ�ɵó�����ȷ˵����
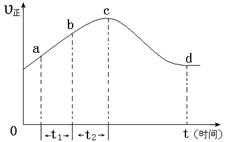
a����Ӧ��c��ﵽƽ��״̬
b����Ӧ��Ũ�ȣ�b��С��c��
c���÷�ӦΪ���ȷ�Ӧ
d����t1����t2ʱ��NO��ת������a��b��С��b��c��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com