
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,判断过量后以不足量代入计算.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,Cu与NO3-过量,H+不足,
n(Cu2+)=0.06mol×$\frac{3}{8}$=0.0225mol,
所得溶液中铜离子物质的量浓度为$\frac{0.0225mol}{0.1L}$=0.225mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意过量计算的判断,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 性质 | 用途 | |
| A | 液氨气化吸热 | 可用作制冷剂 |
| B | NH4HCO3受热易分解 | 可用作氮肥 |
| C | 二氧化硅能与HF反应 | 可用作光导纤维 |
| D | 二氧化硫能使溴水褪色 | 可用作漂白剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
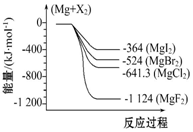 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
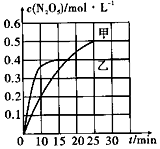 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com