
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg= Mg2++2Ag+2Cl-,有关该电池说法错误的是
A.镁为电池负极B.有24g镁被氧化时,还原得到216g银
C.正极反应为Ag++e-=AgD.可用于海上应急照明
科目:高中化学 来源: 题型:
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是 (填字母).
A.NaClO
B.H2O2
C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.①A元素最外层电子数是次外层电子数的2倍.②B的阴离子和C的阳离子与氖原子的电子层结构相同.③在通常状况下,B的单质是气体,0.1mol B的气体与足量的氢气完全反应共有0.4mol电子转移.④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质.⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应.请写出:
(1)A元素的最高价氧化物的结构式;B元素在周期表中的位置 .
(2)C单质在B单质中燃烧的生成物中所含化学键类型有;C与D 能形成化合物的电子式 .
(3)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为 .
(4)元素D与元素E相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号). a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为g.
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 .
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂.13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量.
(4)KO2加热至600℃部分分解得到产物A.6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比.如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
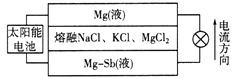
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质的转化关系如图所示,其中甲、乙为单质,丙、丁为化合物. 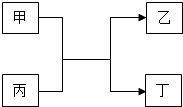
①若工业上用该反应制粗硅写出该反应的化学方程式: .
②若该反应可用于焊接铁轨且丙为红棕色固体则该反应的化学方程式为: .
③若丁为具有磁性的黑色晶体写出该反应的化学方程式: .
④若甲为黄绿色气体,且该反应用来检验工业上甲是否泄漏,写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是周期表前四周期的元素,原子序數依次增大。A的基态原子2p能级上有2个单电子;C是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一;D与F不同周期,但最外能层电子数相等。
(1)写出基态C原子的电子排布式: ____________。
(2)A、B、C三种元素第一电离能最大的是____________。(用元素符号表示),其原因是____________。
(3)B、C两元素形成的化合物B2C的分子空间构型为____________。与B2C互为等电子体的粒子的化学式为____________。(填一种)。
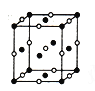
(4)D、E形成的一种离子化合物,在晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,求晶胞的密度ρ=_______g/cm3(用含n、NA的计算式表示)。
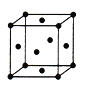
(5)由F原子形成的晶胞结构如图,F原子的半径为r,列式表示F原子在晶胞中的空间利用率:__________________(不要求计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com