
| A.c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中,溶质浓度大小关系:c[(NH4)2SO4]<c(NH4Cl) |
| B.向10 mL 0.10 mol·L-1的CH3COOH溶液中加入等物质的量的NaOH后,溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.两种不同浓度的HA溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1≥10c2 |
| D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32—)+c(OH-) |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源:不详 题型:单选题
| A.在稀盐酸中c(H+)=c(Cl-)+c(OH-) |
| B.常温下,在0.1mol/L的硫酸铵溶液中由水电离出的c(OH-)>10-7mol/L |
| C.如果Na2A的水溶液显中性,该溶液中一定没有电离平衡 |
| D.热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
| B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大 |
| D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(OH-)=10-4 mol·L-1 |
| B.加入少量NaOH固体,c(Na+)和c(HCO3—)均增大 |
| C.c(Na+)+c(H+)=c(HCO3—)+c(OH-) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
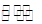 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa) |
| D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] |
| B.0.1 mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S] |
| C.0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-] |
| D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com