美国科研小组曾宣布,火星的岩层中含有丰富的高氯酸盐,为测定其含量,该科研小组进行如下实验:
①取样品10.0g粉碎,用蒸馏水充分溶解、过滤,将滤液稀释到100mL.
②取溶液10mL,用0.01moI/L的碘水滴定,共消耗40mL碘水.
根据上述实验步骤完成下列问题;
(1)完成并配平下面方程式:______ClO-4+______I2+______H2O→______Cl-+______IO-3+______
(2)上述实验中的还原剂是______,指示剂可选用______.
(3)与碘水反应的10mL溶液中ClO-4的物质的量浓度为______.
解:(1)依据氧化还原反应电子守恒和原子守恒配平:ClO
4-~Cl
-~8e
-;I
2~2I0
3-~10e
-;根据电子守恒最小公倍数是40,配平氧化还原反应定量关系;结合反应前后原子守恒计算得到生成物中有氢离子生成;反应的离子方程式为:5ClO
4-+4I
2+4H
2O=5Cl
-+8I0
3-+8H
+;故答案为:5,4,4,5,8,8H
+;
(2)上述实验中的还原剂是I
2,指示剂应选淀粉溶液,滴定过程中溶液颜色有蓝色恰好褪去;
故答案为:I
2,淀粉溶液;
(3)取溶液10mL,用0.01moI/L的碘水滴定,共消耗40mL碘水.碘单质物质的量=0.04L×0.01mol/L=4×10
-4mol;
依据反应离子方程式计算:设10ml溶液中高氯酸跟离子物质的量为x
5ClO
4-+4I
2+4H
2O=5Cl
-+8I0
3-+8H
+;
5 4
x 4×10
-4
x=5×10
-4mol;
10mL溶液中ClO
-4的物质的量浓度=
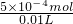
=0.05mol/L;
故答案为:0.05mol/L.
分析:(1)依据氧化还原反应电子守恒和原子守恒配平书写;
(2)元素化合价升高的物质做还原剂;元素化合价降低的物质做氧化剂;滴定实验的指示剂满足反应到终点时的颜色变化来判断反应完全;
(3)结合题干数据和离子方程式进行计算;
点评:本题考查了氧化还原反应的电子守恒应用,配平方法,滴定实验的终点判断,氧化还原反应的计算,溶液浓度的计算.

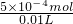 =0.05mol/L;
=0.05mol/L;

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案