
| A. | NH4+、CO32-、Cl-、NO3- | B. | Pb2+、Fe3+、S2-、SO42- | ||
| C. | NH4+、H+、S2O32-、PO43- | D. | Ca2+、Al3+、Br-、CO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A选;
B.Pb2+分别与S2-、SO42-结合生成沉淀,Fe3+、S2-发生氧化还原反应,故B不选;
C.H+、S2O32-发生氧化还原反应,且H+、PO43-不能共存,故C不选;
D.Ca2+、CO32-结合生成沉淀,Al3+、CO32-相互促进水解,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 焓变和熵变是判断反应方向的两个主要因素 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 任何情况下,温度都不可能对反应的方向起决定性作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制硫酸亚铁溶液时,通常在溶液中加入少量的稀硫酸和铁 | |
| B. | 向BaCl2溶液中滴加稀硫酸的过程中,溶液的导电能力不变 | |
| C. | 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32- | |
| D. | 把SO2通入盛有滴加了酚酞的NaOH溶液中,溶液褪色,说明SO2有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
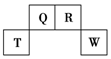 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. .用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
.用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时的Cu为负极 | |
| B. | 充电时电解液的pH升高 | |
| C. | 充电时阳极电极反应为:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 每消耗1molCu,电解质溶液中转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com