
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
分析 在一固定容积的容器中,加入2molSO3,设三氧化硫消耗的物质的量为x,结合化学反应三行计算列式,气体压强之比等于气体物质的量之比,据此计算得到x,三氧化硫的转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:在一固定容积的容器中,加入2molSO3,设三氧化硫消耗的物质的量为x,
2SO3(g)?2SO2(g)+O2(g)
起始量(mol) 2 0 0
变化量(mol) x x 0.5x
平衡量(mol)2-x x 0.5x
达到平衡时压强变为原来的1.2倍,气体物质的量之比等于气体压强之比,
2-x+x+0.5x=2×1.2
x=0.8mol
达到平衡时SO3的转化率=$\frac{0.8mol}{2mol}$×100%=40%,
故选C.
点评 本题考查化学平衡转化率计算,三段式的列式应用,注意气体压强之比等于气体物质的量之比,题目较简单.


科目:高中化学 来源: 题型:解答题
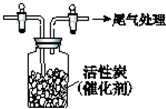 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol | B. | 0.25 mol | C. | 0.1 mol | D. | 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
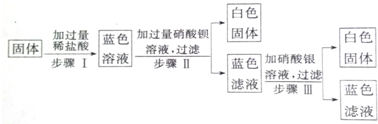
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
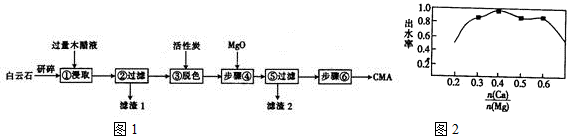
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
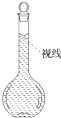
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 油脂是高级脂肪酸的甘油酯,均不能发生氢化反应 | |
| C. | H2N-CH2-COOH既能与盐酸反应、又能与氢氧化钠溶液反应 | |
| D. | 合成橡胶 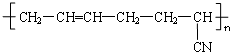 的单体之一是CH3-C≡C-CH3 的单体之一是CH3-C≡C-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com