




 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
 ,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式
,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
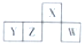 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )| A、元素X、Z的原子半径大小:X>Z |
| B、含Y元素的盐溶液有的显酸性,有的显碱性 |
| C、Y、W的简单氢化物中氢元素的化合价相同 |
| D、钙与W可以形成CaW2化合物,且化合物中含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| X | M | Y |
| T |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0l mol.L-1 的NaOH和NH4Cl 等体积混合后:c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B、0.1mol.L-1Na2S溶液中:c(Na+)=2c(S2-)+c(HS-)+c(H2S) |
| C、在pH<7的CH3COOH和CH3COONa的混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、pH=3的NaHSO3稀溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、能溶解Al2O3的溶液:Na+、K+、Cl-、SiO32- |
| C、无色透明溶液中:Al3+、Cu2+、Cl-、HCO3- |
| D、使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是
(1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 |
| B、在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 |
| C、侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 |
| D、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol[Cu(NH3)4]2+ 中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com