
用Na2CO3、BaCl2和HCl溶液作试剂,除去NaCl溶液中含有的少量的Ca2+和![]() .每种试剂不得重复使用,提纯过的溶液中除了Na+、Cl-、H+和OH-外,不得遗留其他任何离子.
.每种试剂不得重复使用,提纯过的溶液中除了Na+、Cl-、H+和OH-外,不得遗留其他任何离子.
(1)写出加入试剂的顺序.
(2)写出各步反应的离子方程式.
|
解析:由于反应终点较难控制,要使离子完全沉淀,所加试剂必须是过量的,而由过量试剂引入的新杂质亦必须除尽. 此题不能回答为:加入适量Na2CO3溶液,使Ca2+生成CaCO3沉淀,过滤除去;再加入适量BaCl2溶液,使 规律方法:除杂的原则是除去杂质而且不引入新的杂质.有多种杂质离子时应注意除杂顺序. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
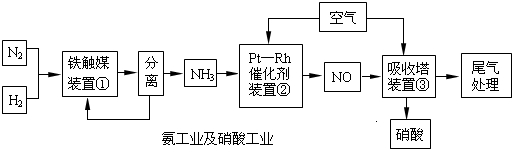
| 催化剂 |
| 加热、加压 |
| 催化剂 |
| 加热、加压 |
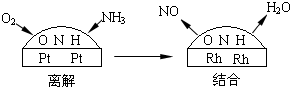
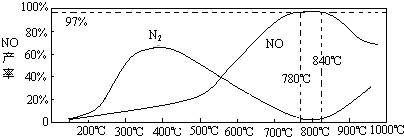
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、硫酸 | C、石灰水 | D、AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:选择题
下列有关实验操作、方法和解释或结论都正确的是
A.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧
B.氯代烃在碱性溶液中水解后用硝酸酸化,再滴加AgNO3溶液,检验氯代烃中的氯原子
C.等体积的pH都为3的酸HA、HB分别与足量的Zn反应,HA放出的H2多,说明酸性:HA>HB
D.为除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂顺序是Na2CO3、Ba(OH)2、盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com