
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是

A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
【答案】A
【解析】
A. 苯和液溴在铁的作用下反应剧烈,可以达到沸腾,使苯和液溴挥发为蒸汽,在经过长导管时,可以将其冷凝并回流;产物中还有HBr气体,经过长导管最终被NaOH吸收,故长导管的作用是导气和冷凝回流。装置B中的CCl4吸收挥发出的溴和苯,CCl4由无色变橙色,A错误;
B. 苯和溴在催化剂条件下反应取代反应生成溴苯和HBr,若苯和溴发生加成反应,则没有HBr生成。装置B中已除去苯和溴的蒸汽,若装置C中产生淡黄色沉淀AgBr,则可证明气体中含有HBr,即可证明装置A中发生取代反应,B正确;
C. 装置B中除去苯和溴的蒸汽,可用NaOH溶液除去HBr气体,C正确;
D. 装置A中生成溴苯,溴苯中因为溶有溴而呈色,用NaOH溶液洗涤后,除去溴,溴苯为无色、密度比水大的油状液体,静置后在分液漏斗的下层,D正确;
故合理选项为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
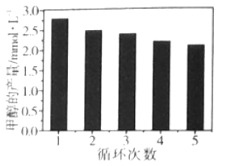
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。

已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________。
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________。

(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________。 pH不能过低的原因是_______________(结合离子方程式说明)。
pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出反应方程式______________________。
(2)工业上制取漂白粉的的过程是把氯气通入石灰乳中,写出反应方程__________________。
(3)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时甲为负极;把乙、丁分别浸入相同浓度的稀硫酸中,乙产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是__________________。
(4)将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,则:vA=_________,反应前A有_________mol。
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:______; __________。
(6)碳是周期表中形成化合物最多的元素,写出其单质与浓硫酸反应的方程式___________________写出能验证碳的非金属性弱于硫的化学反应的离子方程式:_____________________,碳还能形成各种有机物,它的一种有机物可由粮食发酵得到,有特殊的香味,有活血壮胆的功效,写出该有机物在某条件下与氧气催化氧化的反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.32g O2所含的原子数目为NA
B.标准状况下,11.2L H2O中含有的原子数目为1.5 NA
C.2L 0.3mol/L的K2SO4溶液中K+离子的物质的量浓度为1.2mol/L
D.常温下,05 NA个氯气分子的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是一种治疗高血脂病的新药,其合成路线如下:

已知:a. 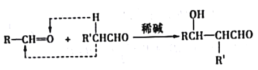 b.
b.  RCHO
RCHO
回答下列问题。
(1)①的反应类型是______________;A的名称是______________。
(2)C中官能团的名称为______________;②的反应条件为______________。
(3)H的结构简式为______________。
(4)写出D→E的化学方程式:______________。
(5)化合物W的相对分子质量比C的大28 ,写出满足下列条件的所有W的结构简式:______________。
①属于芳香族化合物②遇FeCl3溶液能发生显色反应,能发生银镜反应③其核磁共振氢谱有4种不同化学环境的氢,峰面积之比为6:2:1:1
(6)结合题目信息,设计用甲苯和丙醛为原料制备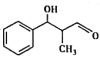 的合成路线_______________。(其他无机原料自选,合成路线用A
的合成路线_______________。(其他无机原料自选,合成路线用A![]() B…
B…![]() 目标产物来表示)
目标产物来表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,2.24 L CC14所含的原子数为0.5 NA
B.常温下,在18g D2O中含有NA个氧原子
C.常温下,7.8 g苯中所含C—H数为0.6NA
D.标准状况下,11.2L乙烯含有非极性共价键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
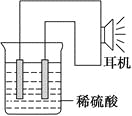
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com