
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=+179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O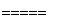 CO+H2+O2
CO+H2+O2
已知:


①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
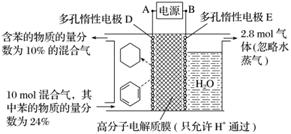
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2013·新课标全国卷Ⅰ,28(3)]二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(ⅰ)CO(g)+2H2(g)===CH3OH(g)
ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH2=-49.0 kJ·mol-1
水煤气变换反应:(ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:(ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)??2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)??(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)??NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)??2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+ O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:__________________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
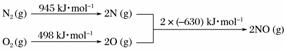
写出该反应的热化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
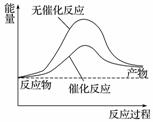
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: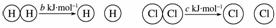
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 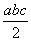 kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
求算下列常温下溶液中由H2O电离的c(H+)和c(OH-)。
(1)pH=2的H2SO4溶液
c(H+)=__________,c(OH-)=__________。
(2)pH=10的NaOH溶液
c(H+)=__________,c(OH-)=__________。
(3)pH=2的NH4Cl溶液
c(H+)=__________。
(4)pH=10的Na2CO3溶液
c(OH-)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
求下列常温条件下溶液的pH(已知lg1.3=0.1,lg2=0.3,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1的H2SO4溶液
(2)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度= ×100%)
×100%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1的NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释到1 000倍
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、“偏低”或“不变”)。
(2)氨气常用________检验,现象是______________________________________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com