
【题目】Na3N是科学家制备的新化合物,它可以和水反应生成两种碱性物质,其中一种A可以发生下列转化关系(A、B、C、D为中学常见物质且均含有同一种元素,反应条件及其他物质已经略去):
A![]() B
B![]() C
C![]() D
D
(1)Na3N中N的化合价为_______;
(2)写出Na3N和水反应的化学方程式_______;
(3)写出C→D的离子方程式_______。
【答案】-3Na3N+3H2O=3NaOH+NH3↑3NO2+HO=2H++2NO3—+NO或SO3+H2O=2H++SO42—
【解析】
(1)氮化钠的化学式为Na3N,在化合物中正负化合价的代数和为0,钠元素的化合价为+1价,则氮元素的化合价为-3;
(2)Na3N与水反应,反应生成两种碱性物质,不是氧化还原反应,为水解反应,生成氢氧化钠和氨气,反应的化学方程式为Na3N+3H2O=3NaOH+NH3↑;
(3)A、B、C、D为中学常见物质且均含有同一种元素,根据题中各物质转化关系,A能经过两步氧化得C,C与水反应生成D,A为H2S或单质硫,B为SO2,C为SO3,D为H2SO4,也可以为A是氮气或NH3,B为一氧化氮,C是NO2、D是HNO3,若含的同一元素为氮元素,则C→D的离子方程式为3NO2+HO=2H++2NO3—+NO,若含的同一元素为硫元素,则C→D的离子方程式为SO3+H2O=2H++SO42—。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是( )
H++OH- △H>0,下列叙述正确的是( )
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小
D. 将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是
2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是
(1)单位时间内生成n mol O2的同时,生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. 仅(1)(4)(5) B. 仅(2)(3)(5)
C. 仅(1)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理.可实现绿色环保、低碳减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3______0(填“>”、“<”或“=”)。
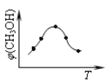
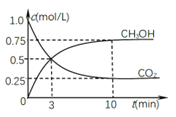
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率_____;第10min后,若升温,将使c(CH3OH)/c(CO2)_____(填“变大”、“减小”、“不变”);判断理由是_________;若向该容器中再充入1molCO2和3molH2,再次达到平衡时,则CH3OH(g)的体积分数将_________(“变大”、“减小”、“不变”)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为___________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由小到大的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以大量共存且溶液是无色的离子组是( )
A.H+、K+、Fe3+、SO42-B.Ba2+、Ca2+、OH-、CO32-
C.H+、Na+、NO3-、Cu2+D.NO3-、SO42-、K+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.分散质粒子的直径在1~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.Fe(OH)3胶体带正电荷,可以产生电泳现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com