
| A. | 水 | B. | 汽油 | C. | 硫酸钠 | D. | 碱液 |
科目:高中化学 来源: 题型:解答题
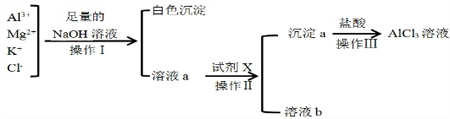 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失查看答案和解析>>
科目:高中化学 来源: 题型:解答题
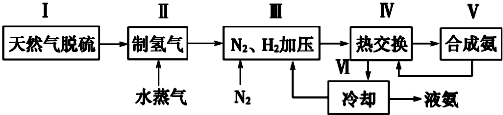
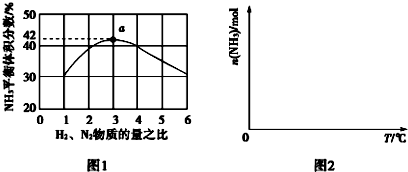
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+O2↑ | |
| B. | 氯化铁溶液和氢氧化钠溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
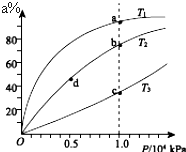 现有反应:mA+nB?ρC,在某温度下达到平衡状态.
现有反应:mA+nB?ρC,在某温度下达到平衡状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com