
【题目】下列关于铜锌稀H2SO4构成的原电池的有关叙述错误的是( )
A. 锌为负极,锌发生氧化反应
B. 铜为正极,但铜不发生反应
C. 负极发生还原反应,正极发生氧化反应
D. 外电路电子流入的一极为正极,电子流出的一极为负极
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等,下图为海水利用的部分过程。

下列有关说法正确的是( )
A. 用澄清石灰水可签别NaHCO3和Na2CO3
B. 从第③步到第⑤步的目的是浓缩
C. 在第③④⑤步中溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率;
B. 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C. 在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体;
D. 实验室用排饱和食盐水的方法收集氯气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种短周期的元素,原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A是所有元素中原子半径最小的;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,E的最高价氧化物对应的水化物既能溶于强酸又能溶于强碱。请问答以下问题:
(1)写出C的元素符号_____,写出F在元素周期表中的位置_______。
(2)写出B、D、E三种元素组成的常见化合物的名称___________。
(3)写出E、F两种元素最高价氧化物对应水化物相互反应的离子方程式_______________。(4)工业生产E的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
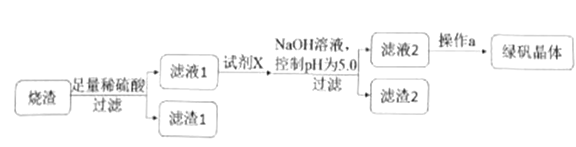
【题目】【加试题】乳酸亚铁:{[CH3CH(OH)COO]2Fe·3H2O,M=288.0g/mol}是一中新型的优良补铁剂,绿白色晶体,溶于水,几乎不溶于乙醇。某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成乳酸亚铁。
已知:
①几种金属离子生成氢氧化物沉淀的PH(开始沉淀的PH按金属离子浓度为1.0mol/L计算)。
金属离子 | 开始沉淀的PH | 沉淀完全的PH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
②研究性学习小组设计的由烧渣制备绿矾晶体的操作流程如下:
③由绿矾(FeSO4·7H2O)制备乳酸亚铁涉及下列反应:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
2CH3CH(OH)COOH+FeCO3+2H2O![]() [CH3CH(OH)COO]2Fe·3H2O+CO2↑。
[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
请回答:
(1)滤渣2的成分为__________(写化学式)。
(2)操作a为蒸发浓缩、冷却结晶、抽滤、洗涤、干燥。洗涤绿矾粗产品的具体操作为_______。
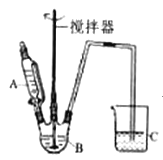
(3)据题干信息,欲制备较纯净的FeCO3时,某同学设计的实验装置示意图如图所示(夹持装置省略)。仪器A 中存放的试剂为________,装置C的作用为___________。
(4)在室温下,将所得的乳酸亚铁成品用无水乙醇进行浸泡2次,从而得到精制产品。选择用无水乙醇进行浸泡的优点是___________(写出两点)。
(5)该学习小组同学用KMnO4滴定法测定样品中Fe2+的量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________。
经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取0.576g样品,溶解后进行必要处理,用0.1000mol/L Ce(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/L Ce(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁的纯度为________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷,石墨,氢气燃烧的反应热:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+![]() O2(g)=H2O(l) ΔH3=―285.8kJ/mol,则由石墨生成甲烷的反应热:
O2(g)=H2O(l) ΔH3=―285.8kJ/mol,则由石墨生成甲烷的反应热:
C(石墨)+2H2(g)=CH4(g) ΔH 4= 。
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m________n(填>、<、= )
(3)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________
(4) 常温下,某一元酸HA的Ka=2×10-5,则0.05 mol/L该酸溶液的PH值=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。
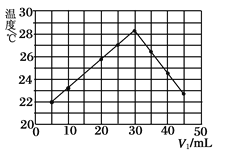
下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的硝酸钾、硫酸钾、磷酸钾(K3PO4)三种溶液中,若使钾离子的物质的量相同,则这三种溶液的体积比为
A.2:3:6
B.1:2:3
C.3:2:1
D.6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com