
| A. | W和Z在同一周期 | |
| B. | 原子半径:W<X<Y<Z | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | W和X形成的简单化合物中只含有共价键 |
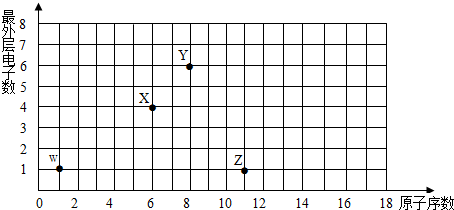
分析 原子序数为横坐标、原子的最外层电子数为纵坐标,由图可知W为H,X为C,Y为O,Z为Na,
A.W、Z的最外层电子数相同;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
C.非金属性越强,对应氢化物越稳定;
D.W和X形成的简单化合物为甲烷.
解答 解:原子序数为横坐标、原子的最外层电子数为纵坐标,由图可知W为H,X为C,Y为O,Z为Na,
A.W、Z的最外层电子数相同,则位于同主族,在不同的周期,故A错误;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径为W<Y<X<Z,故B错误;
C.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:Y>X,故C正确;
D.W和X形成的简单化合物为甲烷,只含C-H共价键,故D正确;
故选CD.
点评 本题考查原子结构与元素周期律,为高频考点,把握图中信息判断元素、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述两溶液中盐酸的物质的量浓度比硫酸的物质的量浓度大 | |
| B. | 硫酸使铝钝化 | |
| C. | 生成的氯化铝能溶于水,而生成的硫酸铝难溶于水 | |
| D. | 氯离子可能破坏氧化铝薄膜,而硫酸根离子不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
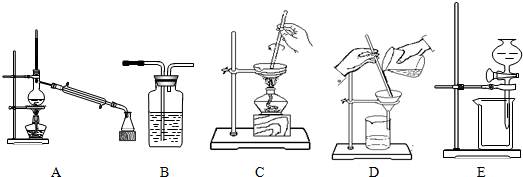
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com