
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用做印刷电路铜板腐蚀剂,反应的离子方程式是 .
(2)硫酸铁可做絮凝剂,常用于净水,其原理是
(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是 .
(3)磁铁矿冶炼铁的原理是Fe3O4+4CO=3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移的电子的物质的量是 .
(4)表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
选项 陈述Ⅰ 陈述Ⅱ 判断
A 铁是地壳中含量最高的金属元素 铁是人类最早使用的金属材料 Ⅰ对;Ⅱ对;有
B 常温下铁与稀硫酸反应生成氢气 高温下氢气能还原氧化铁得到铁 Ⅰ对;Ⅱ对;无
C 铁属于过渡元素 铁和铁的某些化合物可用做催化剂 Ⅰ错;Ⅱ对;无
D 在空气中铁的表面能形成致密的氧化膜 铁不能与氧气反应 Ⅰ对;Ⅱ对;有
考点: 氧化还原反应的电子转移数目计算;氧化还原反应;盐类水解的应用.
分析: (1)金属铜可以和三价铁之间发生氧化还原反应;
(2)三价铁水解生成的氢氧化铁胶体具有净水作用,根据影响化学平衡移动的因素来回答;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数;
(4)A、金属铁的含量和金属铁的使用先后没有因果关系;
B、金属铁可以和酸反应,氢气可以还原出金属氧化物中的金属;
C、铁属于过渡元素,并且铁和铁的某些化合物可用作催化剂;
D、铁能与氧气反应生成氧化铁.
解答: 解:(1)三价铁的氧化性强于铜离子,所以金属铜可以和三价铁之间发生氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+,故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(2)三价铁水解生成的氢氧化铁胶体具有净水作用,原理方程式为:Fe3++3H2O⇌Fe(OH)3+3H+,硫酸铁中由于三价铁水解导致溶液显酸性,而酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去,
故答案为:Fe3++3H2O⇌Fe(OH)3+3H+;酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体;
(3)氧化还原反应Fe3O4+4CO═3Fe+4CO2中,化合价升高值=化合价降低值=转移电子数=8,即有1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol,故答案为:12mol;
(4)A、铁是地壳中含量最高的金属元素,人类最早使用的金属是Cu,故A错误;
B、金属铁可以和酸反应,氢气可以还原出金属氧化物中的金属,二者之间没有因果关系,故B正确;
C、铁属于ⅤⅢ族元素,属于过渡元素,并且铁和铁的某些化合物可用作催化剂,故C错误;
D、铁能与氧气反应生成氧化铁,在空气中铁的表面能形成致密的氧化膜,故D错误.
故选B.
点评: 本题考查了氧化还原反应、盐的水解原理的应用、金属的冶炼等,侧重于对化学基本概念和原理的理解考查,以及利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力,题目难度中等.


科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42﹣、NO3﹣
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3﹣、NO3﹣
C. 0.1 mol•L﹣1AgNO3溶液:H+、K+、SO42﹣、I﹣
D. 0.1 mol•L﹣1NaAlO2溶液:H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
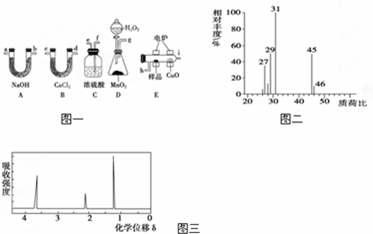
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→f→e→h→i→c(或 .
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 ;.
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
(6)用质谱仪测定其相对分子质量,得如图一所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式能(填“能”或“不能”),若能,则A的分子式是 能,则此空不填).
(8)该物质的核磁共振氢谱如图二所示,则其结构简式为CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
水钴矿(含CuO、Co2O3,Fe2O3、MgO等)用硫酸法浸出铜和钴,如图是不同还原剂对元素浸出率的影响(硫酸浓度3mol•L﹣1,温度60℃),下列说法正确的是()
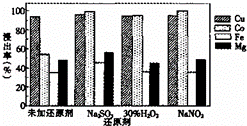
A. 是否使用还原剂对铜的浸出率影响很大
B. 用Na2SO3NaNO2作还原剂,钴的浸出率 均达98%,但工业上宜选用Na2SO3
C. 加入还原剂的主要目的是为了还原Fe3+
D. 用Na2SO3作还原剂可使镁元素以单质 形式析出而有较大浸出率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是()
A. 将NaHCO3固体加入新制氯水中,有无色气泡(H+)
B. 使红色布条退色(HCl)
C. 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D. 滴加AgNO3溶液生成白色沉淀(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验装置是为达成实验目的选用的.图中实验装置与实验目的相匹配的是()
A. 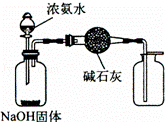
制取干燥纯净的NH3(g)
B. 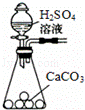
制取大量的CO2气体
C. 
证明Cl2易与NaOH(aq)反应
D. 
测量Cu与HNO3(浓)反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是()
A. 漂白粉露置在空气中失效:ClO﹣+CO2+H2O=HClO+HCO3﹣
B. 向NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
C. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I﹣+H2O2+2H+═I2+2H2O
D. 过氧化钙固体与水反应:2O22﹣+2H2O=4OH﹣+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 .
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(3)曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8.请分析其原因: .
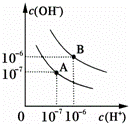
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数说法不正确的是()
A. 醋酸的摩尔质量(单位:g/mol)与NA个醋酸分子的质量在数值上相等
B. NA个氧分子和NA个氢分子的质量比等于16:1
C. 28克氮气所含的原子数目为NA
D. 在标准状况下,0.5NA个氯气分子所占体积约为11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com