
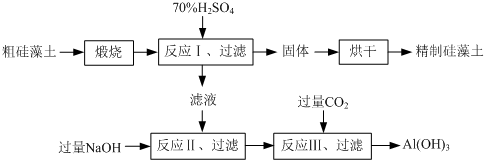
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
 ⑴粗硅藻土高温煅烧的目的是 。
⑴粗硅藻土高温煅烧的目的是 。
⑵反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
⑶实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤5中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
⑴除去有机质 ⑵①NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
②氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
⑶①d ②实验中产生的HF能与玻璃仪器中的SiO2等物质反应
③洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失
④最后一滴滴入后溶液由无色变为粉红色,且30 s不褪色
⑤HF+OH-=F-+H2O (除第⑴小题1分外,其余每空2分,共15分)
【解析】
试题分析:(1)硅藻土中含有少量Fe2O3、Al2O3及有机物等杂质,除去有机杂质可以采用煅烧的方法。
(2)①反应1中氧化铝和稀硫酸反应生成硫酸铝,然后加入过量的氢氧化钠生成偏铝酸钠,则过滤后再通入CO2即可生成氢氧化铝,反应的方程式是NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
②氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面,所以氢氧化铝常用作阻燃剂。
(3)①固体灼烧需要坩埚。由于在高温下,氢氧化钠能和瓷坩埚中的二氧化硅反应,所以应该选择铁坩埚,答案选d。
②由于实验中产生的HF能与玻璃仪器中的SiO2等物质反应,所以实验中使用塑料烧杯和塑料漏斗。
③采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失。
④由于碱液能使酚酞试液显红色,所以步骤5中滴定终点的现象为最后一滴滴入后溶液由无色变为粉红色,且30 s不褪色。
⑤消耗氢氧化钠的物质的量是0.001Vcmol,则根据方程式K2SiF6+3H2O=H2SiO3+4HF+2KF和二氧化硅的含量表达式可知,反应中与氢氧化钠反应的应该是HF。由于HF是弱电解质,则反应的离子方程式是HF+OH-=F-+H2O。
考点:考查二氧化硅的性质、氢氧化铝的制备及用途、中和滴定、化学实验基本操作以及物质含量的有关计算
点评:该题以生产精制硅藻土并获得Al(OH)3的工艺流程为载体,重点考查学生对工艺流程试题了解掌握情况,有利于调动学生的学习兴趣和学习积极性。试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。


科目:高中化学 来源: 题型:阅读理解
| 15cV×10-3 | a |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:计算题
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。

(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为
。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com