
【题目】某种新型电池放电时的总反应方程式为:![]() ,装置如图。下列说法正确的是
,装置如图。下列说法正确的是![]()
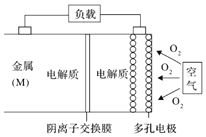
A.放电过程中![]() 通过膜向正极移动
通过膜向正极移动
B.右侧的电极反应式为:![]()
C.若M为Al,则电池放电过程的负极反应式为:![]()
D.在![]() 空气电池中,为防止负极区沉积
空气电池中,为防止负极区沉积![]() ,可改用稀硫酸做电解质溶液
,可改用稀硫酸做电解质溶液
【答案】B
【解析】
已知新型电池放电时的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,电池放电时正极上O2 转化为OH-,负极的M失电子转化为M(OH)n,正极电极反应式为O2+4e-+2H2O=4OH-,负极电极反应式为M-ne-+nOH-═M(OH)n,据此分析解答。
A.阳离子不能通过阴离子交换膜,所以Mn+不能通过膜,故A错误;
B.电池放电时正极上O2 转化为OH-,则右侧的电极反应式为:O2+4e-+2H2O=4OH-,故B正确;
C.若M为Al,Al失电子生成AlO2-,则电池放电过程的负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故C错误;
D.在Mg-空气电池中,改用稀硫酸做电解质溶液,Mg与稀硫酸接触直接反应,故D错误。
故选:B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( )

A.甲池通入![]() 的电极反应式为
的电极反应式为![]()
B.反应一段时间后,丙池中硫酸铜浓度不变
C.当甲池中消耗标况下![]() 时,丙池中粗铜端减重
时,丙池中粗铜端减重![]()
D.乙池中生成白色物质,若将乙醇与氧气互换,乙池中仍生成白色物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池开始成为下一轮电池研究的重点,下图是一种可充电钠离子电池![]() 电解质溶液
电解质溶液![]() 溶液
溶液![]() 工作示意图。下列说法正确的是
工作示意图。下列说法正确的是![]()

A.电池放电时,![]() 从a极区移动到b极区
从a极区移动到b极区
B.电池放电时,b极区发生的反应是![]()
C.金属钠可以作为该电池的负极材料
D.离子交换膜也可以改成阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解反应的应用说法正确的是( )
A.可以把FeCl3固体直接溶于水制FeCl3溶液
B.热的纯碱溶液去油污效果好
C.Al(NO3)3溶液与K2S溶液混合后无明显现象
D.Mg粉投入到饱和NH4Cl溶液中无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4P(红磷,s)![]() P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
A.当1mol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。
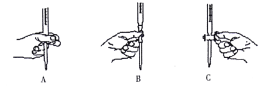
(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[FeSO4·(NH4)2SO4·6H2O]是一种能溶于水、难溶于酒精的浅蓝绿色晶体,常用于定量分析中配制亚铁离子的标准溶液,实验室用下图所示装置制备摩尔盐。下列说法错误的是
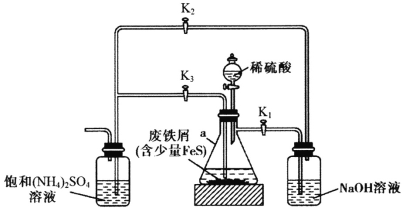
A.铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净
B.用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂
C.实验开始阶段产生的气体是用来排出装置内的空气
D.实验开始时应先打开K1、K3,关闭K2;待a中反应即将完成时,再打开K2,关闭K1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com