
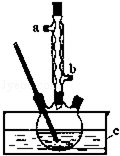
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:分析 (1)混合时密度大的液体注入密度小的液体中,防止混合放热导致液体飞溅;
(2)冷凝管中水下进上出,冷凝效果好;
(3)为保证反应温度恒定在135℃,加热液体能达到的最高温度等于其沸点;
(4)浓硫酸具有脱水性,有机物脱水后C与浓硫酸反应生成有毒气体二氧化硫,二氧化硫与NaOH反应生成亚硫酸钠和水;
(5)分液漏斗分离分层的液体混合物,具有塞子或活塞的仪器需要查漏;
(6)正丁醚易挥发;
(7)结合2C3CH2CH2CH2OH$→_{135度}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O及最终得到6.50g正丁醚计算产率.
解答 解:(1)浓硫酸与其它液体混合时,先加其它液体后加硫酸,防止浓硫酸稀释时放热,引起液体飞溅,所以液体试剂加入顺序是先加正丁醇,后加浓硫酸,
故答案为:先加正丁醇,后加浓硫酸;
(2)用冷凝管冷凝时,冷凝水的流向与气体流向相反,则冷凝水从a口进入,故答案为:a;
(3)加热液体能达到的最高温度等于其沸点,则为保证反应温度恒定在135℃,装置C中所盛液体的沸点应该大于135℃,故答案为:该液体沸点大于135℃;
(4)加热时间过长或温度过高,反应混合液会变黑,浓硫酸与丁醇发生氧化还原反应,浓硫酸被还原生成二氧化硫,用氢氧化钠溶液吸收二氧化硫,其二氧化硫与氢氧化钠的反应离子方程式为2OH-+SO2═SO32-+H2O;
故答案为:2OH-+SO2═SO32-+H2O;
(5)分离分层的液体用分液漏斗,该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、分液漏斗;带有玻璃塞的仪器使用前要检漏,则在使用分液漏斗时要先检验是否漏水;
故答案为:分液漏斗;检验是否漏水;
(6)将分离出的有机层用无水氯化钙干燥,正丁醚易挥发,采用蒸馏的方法获得纯净的正丁醚,故答案为:蒸馏;
(7)由2C3CH2CH2CH2OH$→_{135度}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
74×2 130
14.8g mg
则m=$\frac{14.8g×130}{74×2}$=13.0g,
产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.5g}{13.0g}$×100%=50.0%,
故答案为:50.0%.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、混合物分离提纯、有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$mol | B. | $\frac{m}{64}$mol | C. | $\frac{n}{11.2}$mol | D. | $\frac{n}{22.4}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可表示麦芽糖或淀粉 | |
| B. | 反应②的产物除了乙醇还有一种直线型分子 | |
| C. | 反应①③属于加成反应且所用的催化剂相同 | |
| D. | 乙酸乙酯的同分异构体(不含本身)中能与NaOH溶液反应的有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
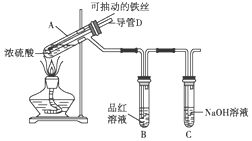 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
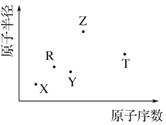 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com