
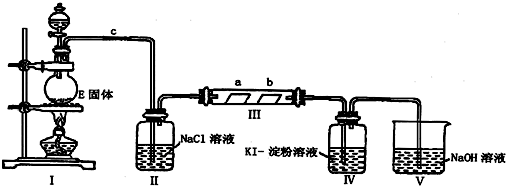
分析 (1)实验室利用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(2)装置I为氯气发生装置,制备的氯气中含有HCl,饱和食盐水除去氯气中HCl,Ⅲ装置验证氯气无漂白性,是氯气和水反应生成的次氯酸具有漂白性,Ⅳ中检验氯气检验氧化性,V中NaOH溶液吸收氯气,防止污染空气;
(3)氯气将碘离子氧化为碘单质,碘与淀粉变蓝色;
(4)进入装置Ⅲ的氯气中含有水蒸汽,应在Ⅱ、Ⅲ之间添加氯气干燥装置,可以用浓硫酸干燥;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水.
解答 解:(1)实验室利用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)装置I为氯气发生装置,制备的氯气中含有HCl,饱和食盐水除去氯气中HCl,Ⅲ装置验证氯气无漂白性,是氯气和水反应生成的次氯酸具有漂白性,Ⅳ中检验氯气检验氧化性,V中NaOH溶液吸收氯气,防止污染空气,装置Ⅱ的作用是:除去氯气中的氯化氢气体,降低氯气在水中的溶解度,
故答案为:除去氯气中的氯化氢气体,降低氯气在水中的溶解度;
(3)装置Ⅳ中发生反应的化学方程式为Cl2+2KI=I2+2KCl,碘与淀粉变蓝色,实验现象为:无色溶液变蓝色,
故答案为:Cl2+2KI=I2+2KCl;无色溶液变蓝色;
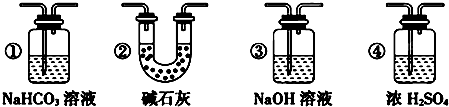
(4)进入装置Ⅲ的氯气中含有水蒸汽,应在Ⅱ、Ⅲ之间添加氯气干燥装置,可以用浓硫酸干燥,选择装置④,
故答案为:干燥Cl2;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查氯气实验室制备与性质实验,侧重考查对实验原理与装置的分析评价,有利于培养学生分析能力、实验能力与知识迁移应用能力,难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LHF中分子总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| D. | .将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
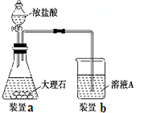 一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 电线短路失火时,用大量的水灭火 | |
| C. | 浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com