
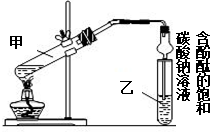
 某学习小组在实验室制取乙酸乙酯的主要步骤如下:
某学习小组在实验室制取乙酸乙酯的主要步骤如下:分析 (1)球形干燥管,除起冷凝作用外,因乙酸、乙醇易溶于水,可防止倒吸;
(2)乙醇、乙酸易挥发,需要检验装置的气密性;
(3)酯化反应为可逆反应,且浓硫酸具有吸水性,乙酸和乙醇发生酯化反应生成乙酸乙酯和水,乙醇脱H;
(4)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(5)饱和碳酸钠溶液与乙酸乙酯分层,且乙酸乙酯的密度比水的密度小,分层后乙酸乙酯在上层,然后分液可分离.
解答 解:(1)装置中球形干燥管,除起冷凝作用外,因乙酸、乙醇易溶于水,另一重要作用是防止倒吸,
故答案为:防止倒吸;
(2)步骤(2)安装好实验装置,加入样品前还应检查装置的气密性,
故答案为:装置的气密性;
(3)酯化反应为可逆反应,且浓硫酸具有吸水性,则浓硫酸的作用为催化剂、吸水剂,乙酸和乙醇发生酯化反应生成乙酸乙酯和水,制备反应为CH3COOH+C2H518OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O,
故答案为:催化剂、吸水剂;CH3COOH+C2H518OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O;
(4)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,只有AC符合,故答案为:AC;
(5)饱和碳酸钠溶液与乙酸乙酯分层,步骤 ③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅,从试管乙中分离出乙酸乙酯的实验操作名称是分液,
故答案为:试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;分液.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的结构与性质、有机反应为解答的关键,侧重分析与实验能力的考查,注意混合物分离的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
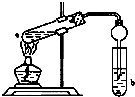 如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
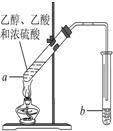 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C2H4 | B. | C2H2和C2H4 | C. | C2H4和C2H6 | D. | C4H8和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为18 | |
| B. | 容器②中达到平衡时放出的热量为0.05Q kJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率增大 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com