
”¾ĢāÄæ”æĻą¶Ō·Ö×ÓÖŹĮæ²»³¬¹ż100µÄÓŠ»śĪļA£¬¼ČÄÜÓė½šŹōÄĘ·“Ó¦²śÉśĪŽÉ«ĘųĢ壬ÓÖÄÜÓėĢ¼ĖįÄĘ·“Ó¦²śÉśĪŽÉ«ĘųĢ壬»¹æÉŅŌŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗĶŹÉ«”£ AĶźČ«Č¼ÉÕֻɜ³ÉCO2ŗĶH2O”£¾·ÖĪöĘäŗ¬ŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ37.21%”£
¢Ł ĘäAµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ________________
¢Ś AµÄŹµŃéŹ½ĪŖ_____________
¢Ū¾ŗĖ“Ź²Õń¼ģ²ā·¢ĻÖAµÄĒāĘ×Ķ¼ČēĻĀ£¬Š“³öAµÄ½į¹¹¼ņŹ½£ŗ_____________

¢ÜŹŌŠ“³öAÓė¼×“¼·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½£ŗ__________________________________”£
”¾“š°ø”æ 86 C2H3O 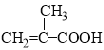

”¾½āĪö”æ¢ŁÓŠ»śĪļÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ37.21%£¬Ļą¶Ō·Ö×ÓÖŹĮæ²»³¬¹ż100£¬ĖłŅŌ·Ö×ÓÖŠŃõŌ×ÓŹżÄæN£ØO£©£¼![]() ”Ö2.3£¬ÓŠ»śĪļÄÜÓėĢ¼ĖįÄĘ·“Ó¦²śÉśĪŽÉ«ĘųĢ壬ĖµĆ÷Ęä·Ö×ÓÖŠŗ¬ÓŠ-COOH£¬ĖłŅŌAÖŠŗ¬ÓŠ2øöŃõŌ×Ó£¬Mr£ØX£©=
”Ö2.3£¬ÓŠ»śĪļÄÜÓėĢ¼ĖįÄĘ·“Ó¦²śÉśĪŽÉ«ĘųĢ壬ĖµĆ÷Ęä·Ö×ÓÖŠŗ¬ÓŠ-COOH£¬ĖłŅŌAÖŠŗ¬ÓŠ2øöŃõŌ×Ó£¬Mr£ØX£©=![]() =86£¬¹Ź“š°øĪŖ£ŗ86£»
=86£¬¹Ź“š°øĪŖ£ŗ86£»
¢ŚÓŠ»śĪļXŗ¬ÓŠōČ»ł£¬ĶźČ«Č¼ÉÕֻɜ³ÉCO2ŗĶH2O£¬ĖµĆ÷ÓŠ»śĪļXÓÉC”¢H”¢OČżÖÖŌŖĖŲ×é³É”£ÉčĢž»łµÄ×é³ÉĪŖCnHm£¬Ģž»łµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ86-45=41£¬ĖłŅŌ12n+m=41£¬
Čōn=1£¬Ōņm=29£Ø²»·ūŗĻ£©£»Čōn=2£¬Ōņm=17£Ø²»·ūŗĻ£©£»Čōn=3£¬Ōņm=5£Ø·ūŗĻ£©£»
ĖłŅŌĢž»łµÄ×é³ÉĪŖC3H5£¬AĪŖC3H5-COOH£¬Ę䏵ŃéŹ½ĪŖC2H3O”£
¢Ūøł¾ŻAµÄŗĖ“Ź²ÕńĒāĘ×£¬µĆµ½AÖŠÓŠČżÖÖHŌ×Ó£¬ŹżĮæ±ČĪŖ3:2:1”£ĘäÖŠ1øöHµÄ·åĪŖōČ»ł£¬ŌņĮķĶāŅ»¶ØÓŠŅ»øö-CH3ŗĶŅ»øö-CH2-”£ŌŁ½įŗĻAæÉŅŌŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗĶŹÉ«£¬ĖµĆ÷AÖŠÓŠĢ¼Ģ¼Ė«¼ü”£ĖłŅŌAµÄ½į¹¹¼ņŹ½ĪŖ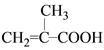 ”£
ӣ
¢ÜAÓė¼×“¼·¢Éśõ„»Æ·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ£ŗ


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉś»īÖŠµÄÓŠ»śĪļÖÖĄą·įø»£¬ŌŚŅĀŹ³×”ŠŠµČ¶ą·½ĆęÓ¦ÓĆ¹ć·ŗ£¬ĘäÖŠŅŅ“¼ŹĒ±Č½Ļ³£¼ūµÄÓŠ»śĪļ£®
£Ø1£©ŅŅ“¼ŹĒĪŽÉ«ÓŠĢŲŹāĻćĪ¶µÄŅŗĢ壬ĆܶȱČĖ® £®
£Ø2£©¹¤ŅµÉĻÓĆŅŅĻ©ÓėĖ®·“Ó¦æÉÖʵĆŅŅ“¼£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £® £Ø²»ÓĆŠ“·“Ó¦Ģõ¼ž£©
£Ø3£©ĻĀĮŠŹōÓŚŅŅ“¼µÄĶ¬ĻµĪļµÄŹĒ £¬ ŹōÓŚŅŅ“¼µÄĶ¬·ÖŅģ¹¹ĢåµÄŹĒ £® £ØŃ”Ģī±ąŗÅ£©
A£® 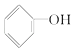 B£®
B£® 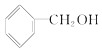 C£®CH3 CH2©O©CH2CH3 D£®CH3 OH E£®CH3©O©CH3 F£®HO©CH2CH2©OH
C£®CH3 CH2©O©CH2CH3 D£®CH3 OH E£®CH3©O©CH3 F£®HO©CH2CH2©OH
£Ø4£©ŅŅ“¼Äܹ»·¢ÉśŃõ»Æ·“Ó¦£ŗ
¢ŁŅŅ“¼ŌŚĶ×÷“߻ƼĮµÄĢõ¼žĻĀæɱ»ŃõĘųŃõ»Æ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
¢Ś46gŅŅ“¼ĶźČ«Č¼ÉÕĻūŗÄ molŃõĘų£®
¢ŪĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ØŃ”Ģī×ÖÄø£©£®
A£®ŅŅ“¼²»ÄÜŗĶĖįŠŌøßĆĢĖį¼ŲČÜŅŗ·¢ÉśŃõ»Æ»¹Ō·“Ó¦
B£®ŹµŃéŹŅÖĘŅŅĻ©Ź±£¬ĪĀ¶ČæŲÖĘŌŚ140”ę
C£®»Ę¾Ę֊ijŠ©Ī¢ÉśĪļ½«ŅŅ“¼Ńõ»ÆĪŖŅŅĖį£¬ÓŚŹĒ¾Ę¾Ķ±äĖįĮĖ
D£®³ĀÄźµÄ¾ĘŗÜĻćŹĒŅņĪŖŅŅ“¼ŗĶŅŅ“¼±»Ńõ»ÆÉś³ÉµÄŅŅĖį·¢Éśõ„»Æ·“Ó¦£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠ“óĮæ“ęŌŚŅŌĻĀĪåÖÖĄė×ÓNO ![]() ”¢SO
”¢SO ![]() ”¢Al3+”¢H+”¢M£®ĘäĪļÖŹµÄĮæÅضČÖ®±ČĪŖc£ØNO
”¢Al3+”¢H+”¢M£®ĘäĪļÖŹµÄĮæÅضČÖ®±ČĪŖc£ØNO ![]() £©£ŗc£ØSO
£©£ŗc£ØSO ![]() £©£ŗc£ØAl3+£©£ŗc£ØH+£©£ŗc£ØM£©=4£ŗ3£ŗ1£ŗ3£ŗ2£¬ŌņMæÉÄÜŹĒ£Ø £©
£©£ŗc£ØAl3+£©£ŗc£ØH+£©£ŗc£ØM£©=4£ŗ3£ŗ1£ŗ3£ŗ2£¬ŌņMæÉÄÜŹĒ£Ø £©
A.Fe2+
B.Cl©
C.Mg2+
D.Ba2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.³£ĪĀ³£Ń¹ĻĀ£¬2gH2ŗ¬ÓŠµÄĒāŌ×ÓŹżÄæĪŖ2NA
B.±ź×¼×“æöĻĀ£¬22.4LCCl4ÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖNA
C.±ź×¼×“æöĻĀ£¬20gD2OÖŠŗ¬ÓŠµÄµē×ÓŹżĪŖ10NA
D.³£ĪĀ³£Ń¹ĻĀ£¬1molL©1K2CO3ČÜŅŗÖŠŗ¬ÓŠµÄ¼ŲĄė×ÓŹżÄæĪŖ2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖŹµŃéŹŅijÅØŃĪĖįŹŌ¼ĮĘæÉĻµÄ±źĒ©µÄÓŠ¹ŲÄŚČŻ£¬ŹŌøł¾Ż±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆÅØŃĪĖįÖŠHClµÄĪļÖŹµÄĮæÅضČĪŖmolL©1 £®
£Ø2£©ĻÖÓĆøĆÅØŃĪĖįÅäÖĘ100mL 1molL©1µÄĻ”ŃĪĖį£®æɹ©Ń”ÓƵÄŅĒĘ÷ÓŠ£ŗ
¢Ł½ŗĶ·µĪ¹Ü””¢ŚÉÕĘæ””¢ŪÉÕ±””¢ÜŅ©³×
¢ŻĮæĶ²””¢ŽĶŠÅĢĢģĘ½
ÅäÖĘĻ”ŃĪĖįŹ±£¬ÉĻŹöŅĒĘ÷ÖŠŠčŅŖŹ¹ÓƵÄÓŠ£ØŃ”ĢīŠņŗÅ£©£¬»¹Č±ÉŁµÄŅĒĘ÷ÓŠ£ØŠ“ŅĒĘ÷Ćū³Ę£©£®
£Ø3£©ÅäÖĘ100mL 1molL©1µÄĻ”ŃĪĖįŠčŅŖÓĆĮæĶ²ĮæČ”ÉĻŹöÅØŃĪĖįµÄĢå»żĪŖmL£Ø±£ĮōŅ»Ī»Š”Źż£©£¬ĮæČ”ÅØŃĪĖįŹ±Ó¦Ń”ÓĆ£ØŃ”Ģī¢Ł10mL””¢Ś50mL””¢Ū100mL£©¹ęøńµÄĮæĶ²£®
£Ø4£©ŹµŃéÖŠŌģ³ÉĖłÅäČÜŅŗÅضČĘ«øßµÄŌŅņæÉÄÜŹĒ £®
A.Ī“¾ĄäČ“£¬Į¢¼“×ŖŅĘÖĮČŻĮæĘæ²¢Ļ“µÓÉÕ±£¬¶ØČŻ
B.ÓĆĮæĶ²ĮæČ”ŅŗĢåŹ±ŃöŹÓ¶ĮŹż
C.ÉÕ±Ć»ÓŠĻ“µÓ
D.ijĶ¬Ń§ŌŚ¶ØČŻ¹Ū²ģŅŗĆꏱø©ŹÓ
E.¶ØČŻŗó¾Õńµ“”¢Ņ”ŌČ”¢¾²ÖĆ£¬·¢ĻÖŅŗĆęĻĀ½µ£¬ŌŁ¼ÓŹŹĮæµÄÕōĮóĖ®
F.ČŻĮæĘæÖŠŌĄ“ŗ¬ÓŠÉŁĮæÕōĮóĖ®£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫10.6gNa2CO3ČÜÓŚĖ®Åä³É1LČÜŅŗ£®
£Ø1£©øĆČÜŅŗÖŠNa2CO3µÄĪļÖŹµÄĮæÅضČĪŖ £¬ ČÜŅŗÖŠNa+µÄĪļÖŹµÄĮæÅضČĪŖ
£Ø2£©ĻņøĆČÜŅŗÖŠ¼ÓČėŅ»¶ØĮæµÄNaCl ¹ĢĢ壬Ź¹ČÜŅŗÖŠNa+ µÄĪļÖŹµÄĮæÅضČĪŖ0.4molL©1£Ø¼ŁÉčČÜŅŗĢå»ż²»±ä£©Šč¼ÓČėNaClµÄÖŹĮæĪŖ £¬ Cl© µÄĪļÖŹµÄĮæÅضČĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČõµē½āÖŹµÄµēĄėĘ½ŗā”¢ŃĪĄąµÄĖ®½āĘ½ŗāŗĶÄŃČÜĪļµÄČܽāĘ½ŗā¾łŹōÓŚ»ÆŃ§Ę½ŗā£¬øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ļņ ZnSO4ČÜŅŗÖŠµĪ¼Ó±„ŗĶH2SČÜŅŗ£¬Ć»ÓŠ³ĮµķÉś³É£¬¼ĢŠųµĪ¼ÓŅ»¶ØĮæµÄ°±Ė®ŗó£¬Éś³ÉZnS³Įµķ£¬ÓƵēĄėĘ½ŗāŌĄķ½āŹĶÉĻŹöĻÖĻó _______________________________________________ ”£
£Ø2£©AlCl3ČÜŅŗÕōøɲ¢×ĘÉÕµĆµ½µÄĪļÖŹŹĒ__________ £ØĢī»ÆѧŹ½£©”£
£Ø3£©0.1 mol”¤L£1µÄ(NH4)2SO4ČÜŅŗ£¬ŌŚøĆČÜŅŗÖŠø÷ÖÖĄė×ÓµÄÅضČÓɓ󵽊”Ė³ŠņĪŖ_____________”£
£Ø4£©0.1mol”¤L£1µÄNaHAČÜŅŗÖŠ£¬Į£×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ£ŗc£ØNa+£©>c£ØHA”Ŗ£©>c£ØH2A£©>c£ØA2££©
¢ŁøĆČÜŅŗÖŠĻŌ________£ØĢī”°ĖįŠŌ”±”¢”°¼īŠŌ”±»ņ”°ÖŠŠŌ”±£©£»
¢Ś×÷³öÉĻŹöÅŠ¶ĻµÄŅĄ¾ŻŹĒ___________________________________________£ØÓĆĪÄ×Ö½āŹĶ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§°“ĻĀĮŠ²½ÖčÅäÖĘ100mL0.200molL©1Na2CO3ČÜŅŗ£¬Ēė»Ų“šÓŠ¹ŲĪŹĢā£®ŹµŃé²½ÖčÓŠ¹ŲĪŹĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚČ²ĢžµÄĆčŹöÕżČ·µÄŹĒ(””””)
A.·Ö×ÓĄļŗ¬ÓŠĢ¼Ģ¼Čż¼üµÄ²»±„ŗĶĮ“Ģž½ŠČ²Ģž
B.Č²Ģž·Ö×ÓĄļµÄĖłÓŠĢ¼Ō×Ó¶¼ŌŚĶ¬Ņ»Ö±ĻßÉĻ
C.Č²ĢžŅ×·¢Éś¼Ó³É·“Ó¦£¬Ņ²Ņ×·¢ÉśČ”“ś·“Ó¦
D.Č²Ģž²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬µ«æÉŅŌŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com