
分析 根据c=$\frac{1000ρw}{M}$计算;
根据稀释定律c1V1=c2V2计算稀释后盐酸的浓度;
①根据Mg的质量求出其物质的量,求出HCl的物质的量,根据方程式计算氢气的物质的量和体积;
②(1)根据被氧化的HCl的物质的量求出氯气的物质的量;
(2)根据反应方程式计算.
解答 解:密度为1.17g.mL-1、质量分数为36.5%的浓盐酸物质的量浓度=$\frac{1000×1.17×36.5%}{36.5}$mol/L=11.7mol/L,
根据稀释定律,稀释后盐酸的浓度=$\frac{11.7mol/L×43mL}{200mL}$=2.52mol/L,
答:此浓盐酸的物质的量浓度为11.7mol/L;稀盐酸的物质的量浓度为2.52mol/L;
①n=$\frac{m}{M}$=$\frac{4.8g}{24g/mol}$=0.2mol,n(HCl)=cV=11.7mol/L×0.043L=0.5031mol;
由方程式方程式Zn+2HCl=ZnCl2+H2↑可知,HCl过量,按照Zn计算,则生成氢气为n(H2)=n(Zn)=0.2mol,其体积为0.2mol×22.4L/mol=4.48L;
答:氢气的体积为4.48L;
②(1)用MnO2,和此浓HCl反应制Cl2,当有0.4molHCl被氧化时,由氯原子守恒可知生成氯气的物质的量为0.2mol;
答:生成氯气为0.2mol;
(2)2Cl2+2Ca(OH)2=CaCl2 +Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g
答:漂白粉质量为25.4克.
点评 本题考查物质的量浓度与质量分数的计算、根据方程式计算,比较基础,侧重对基础知识的巩固,可以利用原子守恒计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
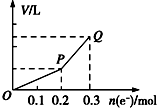 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.15 mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.075mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )| A. | 甲的命名中主链选择是错误的 | |
| B. | 乙的命名中对主链碳原子的编号是错误的 | |
| C. | 丙的命名中主链选择是正确的 | |
| D. | 丁的命名是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质微粒的大小不同 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧:火星四射,生成红色固体 | |
| B. | 硫粉在空气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 | |
| C. | 镁条在空气中燃烧:发出耀眼的白光,只生成一种黑色固体 | |
| D. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①②③④⑤ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com