
分析 (1)二氧化碳的排放,导致全球温度升高;
(2)CO易与血液中血红蛋白结合,使人体中毒;
(3)天然气的主要成分为甲烷;
(4)氧气可供人呼吸;
(5)氮气的性质稳定、无毒,可防止食品氧化.
解答 解:(1)二氧化碳的排放,导致全球温度升高,则造成温室效应的气体是⑤,故答案为:⑤;
(2)CO易与血液中血红蛋白结合,使人体中毒,吸烟时产生的一种易与血液中血红蛋白结合的有毒气体是③,故答案为:③;
(3)天然气的主要成分为甲烷,即为④,故答案为:④;
(4)氧气可供人呼吸,则医疗上用于急救病人的是①,故答案为:①;
(5)氮气的性质稳定、无毒,可防止食品氧化,则用于食品包装时作保护气的是②,故答案为:②.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境污染问题、化学与生活为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
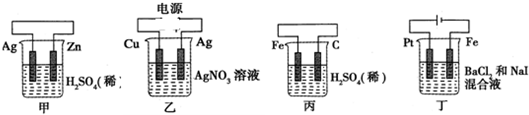
| A. | 甲中负极反应式为:Ag-e-=Ag+ | |
| B. | 乙中阳极反应式为:Cu-2e-=Cu2+ | |
| C. | 丙中H+向碳棒方向移动 | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=2的酸溶液稀释到原来的$\frac{1}{10}$,溶液的pH一定变为3 | |
| B. | 将pH=2的盐酸和pH=4的盐酸等体积混合后,溶液的pH变为3 | |
| C. | 将pH=12的Ba(OH)2溶液稀释到原来的$\frac{1}{10}$,溶液的pH变为13 | |
| D. | 将0.005mol•L-1的硫酸与pH=12的Ba(OH)2溶液等体积混合后,溶液的pH为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
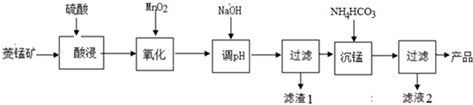
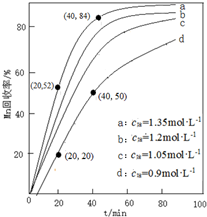
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
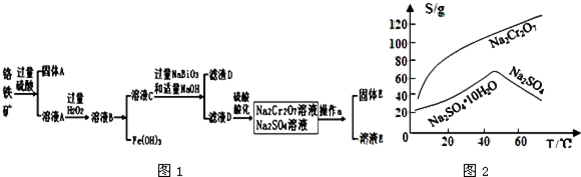
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
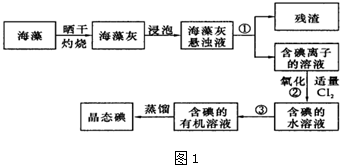
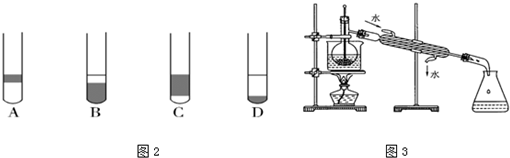
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
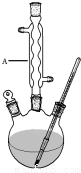 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(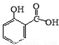 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| B. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 | |
| C. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| D. | 研发光电转换材料,充分利用太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com