
下列关于有机化合物的叙述错误的是
A.甲烷和乙烯可以用溴水鉴别
B.煤油是石油的分馏产品,可用于保存少量的钠
C.棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质
D.用饱和碳酸钠溶液可除去乙酸乙酯中混有的乙酸和乙醇
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
下列物质中,不能发生消去反应的是( )
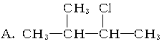 B. CH2 CH2Br2
B. CH2 CH2Br2
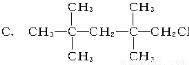 D.CH2ClCH2CH3
D.CH2ClCH2CH3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:简答题
(13分)有A、B、C、D、 E、R六种短周期元素,其元素特征信息如下表:
E、R六种短周期元素,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
D | 其氢氧化物和氧化物都有两性,且与C同周期 |
E | 与C同周期,其原子半径在该周期最小 |
R | 有多种化合价,其最高正价为+6价 |
回答下列问题:
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
13C-NMR (核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A.13C与15N具 有相同的中子数 B.13C与C60是同一种物质
有相同的中子数 B.13C与C60是同一种物质
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:填空题
(17分)运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下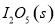 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: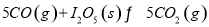
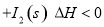 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量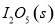 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数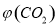 随时间的变化如下图所示。
随时间的变化如下图所示。
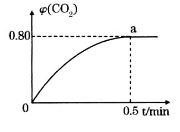
①0~0.5min内的平均反应速率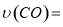 _____________。
_____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是____________(填代号)。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中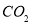 的体积分数
的体积分数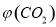 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以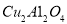 为催化剂,可以将
为催化剂,可以将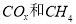 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则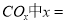 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应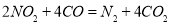 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:实验题
(18分)废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备CoxOy,的工艺流程简图如下:
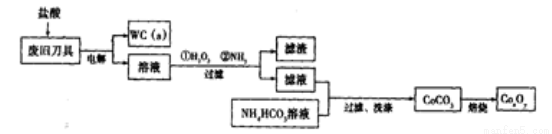
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是______。
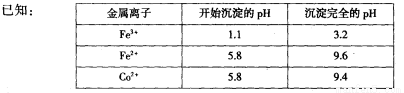
(2)通人氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是____________。
(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,选用的加料方式是_______(填代号),原因是_______。
a.将滤液与NH4HCO3溶液同时加入到反应容器中
b.将滤液缓慢加入到盛有NH4HCO3溶液的反应容器中
c.将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中
写出生成CoCO3的离子方程式______________________________________。
(4)实验中获得的若洗涤不充分,在焙烧时会产生污染性气体,该污染性气体的成分为_______________(填化学式)。
(5)实验室用下列装置制取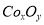 ,并测定其化学式。
,并测定其化学式。
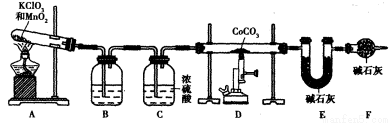
①装置A制得的中含有少量Cl2,则装置B中所盛放的试剂为______(填代号)。
a.NaHCO3溶液 b.NaOH溶液 c.KMnO4溶液 d.饱和NaCI溶液
②在CoCO3完全转化为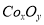 后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物
后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物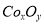 的化学式为____________。
的化学式为____________。
③若缺少装置F,则导致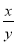 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.酸式滴定管注入Na2CO3溶液之前应检查是否漏液
B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
D.除去Fe(OH)3固体中少量:Mg(OH)2加入足量饱和FeCl3溶液,充分搅拌后过滤
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
某烯烃与H2加成后的产物是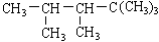 , 则其结构式可能有
, 则其结构式可能有
A.1种B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:填空题
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
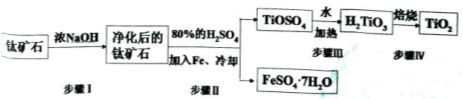
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com