
【题目】选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H=____________kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 ____________。
②在该温度下反应的平衡常数K=________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
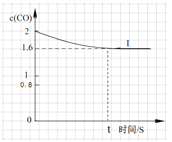
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。______________
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
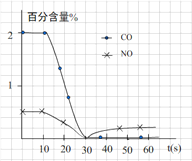
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是__________________。
【答案】 a-b 0.02mol·L-1·S-1 1.25 AD  尚未达到催化剂工作温度(或尚未达到反应的温度)
尚未达到催化剂工作温度(或尚未达到反应的温度)
【解析】试题分析:(1)根据盖斯定律,反应N2(g)+ O2(g)= 2NO(g)的H=H1—H2=(a-b)kJmol-1。
(2)①根据三段式进行计算,2NO(g)+2CO(g) N2(g)+ 2CO2(g)
初始浓度(molL1) 0.5 2 0 0
转化浓度(molL1) 0.4 0.4 0.2 0.4
平衡浓度(molL1) 0.1 1.6 0.2 0.4
则前20S内平均反应速率v(NO)=0.4mol/L÷20S=0.02mol·L-1·S-1。
②该温度下反应的平衡常数K=0.2×0.42÷(0.12×1.62)=1.25。
③A、达到平衡时,移走部分CO2,生成物浓度减小,平衡将向右移动,反应物浓度逐渐减小,正反应速率减小,故A错误;B、缩小容器的体积,气体的压强增大,平衡将向右移动,故B正确;C、因为催化剂能同等倍数的增大正反应速率和逆反应速率,所以应选用乙催化剂,故C正确;D、若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则浓度商Q=1×0.42÷(0.12×1.62)="4" >K,所以反应向左进行,即v正 < v逆,故D错误。
④将0.5 mol NO、2 mol CO投入2 L容器进行反应,则起始时CO的浓度为1molL1,因为起始浓度变为原反应的1/2,所以反应速率减小,则达到化学平衡的时间变长,因为容积为2L,为原反应的2倍,所以压强减小,平衡向左移动,则c(CO) > 0.8,可画出图像。
(3)催化剂的催化作用需要在一定温度下才能充分体现出来,所以前0—10 s 阶段,CO、NO百分含量没明显变化的原因是:尚未达到催化剂工作温度(或尚未达到反应的温度)。


科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
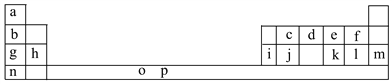
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
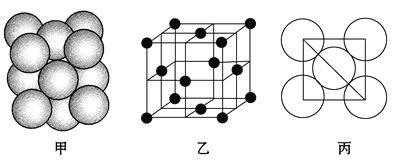
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 乙醇和乙酸均可与NaOH溶液发生酸碱中和反应
B. 苯分子中存在典型的碳碳双键,可发生加成反应
C. 苯分子能发生取代反应
D. 加热银氨溶液与淀粉溶液的混合液可用于检验淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。比如:

(1)上图所示的物质分类方法名称是 ;
(2)按上述分类法,下列物质中Fe、O2、H2SO4、Ba(OH)2、Ca(HCO3)2、SO2属于酸的是__________,这些物质间有的可发生化学反应,请写出一个属于置换反应的离子方程式:___________________;
人们利用分类法对化学物质和化学反应进行分类学习,例如CO2属于二元弱酸的酸性氧化物,Ca(OH)2属于强碱,已知将过量CO2缓缓通入澄清石灰水中,溶液先变浑浊,后又变澄清;NaOH也属于强碱,请写出:
少量CO2与NaOH溶液反应的离子方程式:____________________________;
过量CO2与NaOH溶液反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成,其中C中有两种阳离子:

为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D的化学式:C________,D________。
(2)将含1 mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为___________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________________。
(4)若向含溶质l mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com