
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )

A. 闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质
B. 闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化
C. 闭合开关K,向溶液中加入CaCO3固体,电流计示数不变
D. 选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同
【答案】C
【解析】
A.当开关K闭合后,电流计指针发生偏转,说明形成回路;
B.闭合开关K,往烧杯中加入NaCl固体,根据离子浓度变化判断电流计指针变化;
C.闭合开关K,往溶液中加入CaCO3固体,与HCl反应生成氯化钙、水和二氧化碳,根据离子浓度变化判断电流计指针变化;
D. 盐酸和硫酸浓度相同时溶液中离子浓度不同,导电能力不同,以此解答。
A.开关闭合后,电流计指针偏转说明溶液中存在自由移动的离子,HCl发生了电离,HCl是电解质,但HCl溶液为混合物,不是电解质,A错误;
B.向HCl溶液中加入NaCl固体,溶液中自由移动的离子浓度增大,导电能力增强,电流计示数增大,B错误;
C.向HCl溶液中加入CaCO3固体,由于2H++CaCO3===Ca2++CO2↑+H2O,溶液中自由移动的离子浓度减小,但离子所带电荷数增大,导电性不变,电流计示数不变,C正确;
D.盐酸和硫酸浓度相同时溶液中离子浓度不同,导电能力不同,电流计示数不同,D错误。
综上所述,本题选C。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
![]()
![]()
![]()
![]() 尾气处理
尾气处理
(1)写出实验室制取氯气的离子方程式____________________________,NA表示阿伏加德罗常数的值,若有4 mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含2 mol HCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)0.5 mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度时:2SO2(g)+O2(g)![]() 2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+ ![]() O2(g)H2O(l),反应过程中能量变化如图所示,则:
O2(g)H2O(l),反应过程中能量变化如图所示,则:
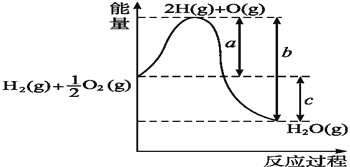
①a、b、c分别代表什么意义?
a___________________________________;
b_____________________________;
c___________________________________。
②该反应是______反应(填“吸热”或“放热”),ΔH_______0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是______。(请写两条)
(3)已知:H2(g)+ ![]() O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(l)H2(g) ΔH=+0.92 kJ·mol-1
O2(l)O2(g) ΔH=+6.84 kJ·mol-1
请写出1mol液氢和液氧生成液态水的热化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
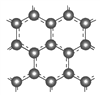
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
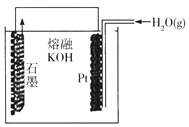
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的核外电子排布式为1s22s22p6,下列关于该微粒的说法一定正确的是( )
A. 质子数为10 B. 单质具有还原性
C. 是单原子分子 D. 电子数为10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com