
| A. | 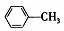 的一溴代物和 的一溴代物和 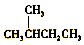 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | C5H11Cl有3种同分异构体 | |
| C. | 按系统命名法,化合物 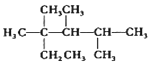 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一直线上 |
分析 A.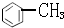 和
和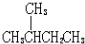 均含4种H;
均含4种H;
B.根据C5H11-的同分异构体判断;
C.主链有6个C原子;
D.含有碳碳三键,具有乙烯的结构.
解答 解:A.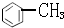 和
和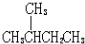 均含4种H,则一溴代物都有4种,故A正确;
均含4种H,则一溴代物都有4种,故A正确;
B.分子式为C5H11Cl的同分异构体有:主链有5个碳原子的一氯代物为:CH3CH2CH2CH2CH2Cl、CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3;主链有4个碳原子的一氯代物为:CH3CH(CH3)CH2CH2Cl、CH3CH(CH3)CHClCH3、CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;主链有3个碳原子的一氯代物为:CH2C(CH3)2CH2Cl,根据分析可知,C5H11Cl的同分异构体总共有8种,故B错误;
C.应为22,3,4-四甲基-己烷,故C错误;
D.含有碳碳三键,具有乙烯的结构,则不可能在同一个直线上,故D错误.
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com