
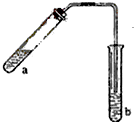
 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:

科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中加入过量的NH4HSO4溶液Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
| B、工业上用石灰乳制漂粉精:2OH-+Cl2=Ca2++Cl-+ClO-+H2O |
| C、向漂白粉溶液中通入一定量的SO2Ca2++3ClO-+SO2+H2O=CaSO4+Cl-+2HClO |
| D、向100mL 0.1mol/L NaOH溶液中滴入数滴0.2mol/L Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、25℃时,1.0L pH=9的CH3COONa溶液中H+和CH3COOH的总数目为10-5NA |
| D、己知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将2NA 个SO2分子和NA 个O2,分子置于一密闭容器中充分反应后放出QkJ的 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:| 序号 | 气体 | 反应原理 | A中试剂 |
| ① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | |
| ② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是 | NaOH溶液 |
| ③ | 乙炔 | 电石与饱和食盐水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
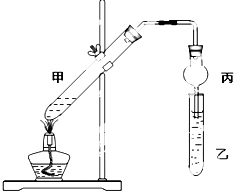 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com