
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO${\;}_{3}^{2-}$)>c(H2SO3) | |
| B. | 使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH-)>c(H+) | |
| C. | 在0.1 mol•L-1 Na2CO3溶液中:c(HCO${\;}_{3}^{-}$)=c(H2CO3)+c(H+)-c(OH-) | |
| D. | 等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
分析 A.pH=5的NaHSO3溶液呈酸性,说明HSO3-的电离程度大于水解程度;
B.使酚酞呈红色的苯酚与苯酚钠混合溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒判断;
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒及物料守恒判断;
D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中溶质是醋酸钠,根据物料守恒判断.
解答 解:A.pH=5的NaHSO3溶液呈酸性,说明HSO3-的电离程度大于水解程度,但电离和水解程度都较小,所以c(HSO3-)>c(SO${\;}_{3}^{2-}$)>c(H2SO3),故A正确;
B.使酚酞呈红色的苯酚与苯酚钠混合溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>c(C6H5O-),苯酚电离和苯酚钠水解程度都较小,所以存在:c(Na+)>c(C6H5O-)>c(OH-)>c(H+),故B正确;
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+),所以得c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),c(HCO${\;}_{3}^{-}$)=c(OH-)-2c(H2CO3)-c(H+),故C错误;
D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中溶质是醋酸钠,根据物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,灵活运用电荷守恒及物料守恒来分析解答,易错选项是C,题目难度中等.


科目:高中化学 来源: 题型:选择题
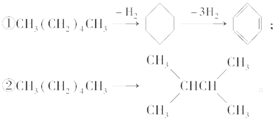 增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )| A. | 石油分馏后得到的汽油远不能满足需求,故常用裂化等方法生产更多的轻质油 | |
| B. | 使用含铅抗爆剂,会导致铅污染,故目前已禁止使用 | |
| C. | ①②均为消去反应 | |
| D. | ①②反应过程中有机物碳原子数均没有发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | |
| 步骤4: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 物质的量是度量物质所含微观粒子多少的物理量 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 等质量的O2和O3中所含氧原子个数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com