
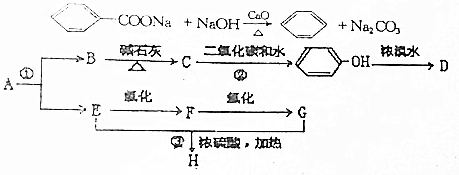
 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.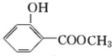 ,
,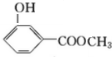 .
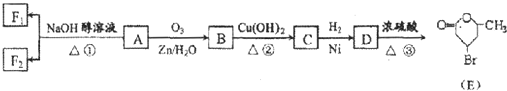
.分析 E氧化生成F,F氧化生成G,则E为醇,F为醛,G为羧酸,E与F生成的H为酯,化合物H能发生银镜反应,则H为甲酸酯,故E为CH3OH,F为HCHO,G为HCOOH,H为HCOOCH3.A转化得到B与甲醇,B与碱石灰发生信息中脱羧反应得到C,C与二氧化碳、水反应得到苯酚,则C为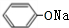 ,化合物A苯环上的一硝基取代物有四种,则苯环上含有2个不同的取代基且不是对位位置,则A中含有酯基与酚羟基,可知A为
,化合物A苯环上的一硝基取代物有四种,则苯环上含有2个不同的取代基且不是对位位置,则A中含有酯基与酚羟基,可知A为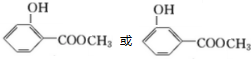 ,B为
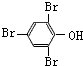
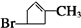
,B为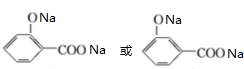 .苯酚与溴水发生取代反应生成D为
.苯酚与溴水发生取代反应生成D为 .
.
解答 解:E氧化生成F,F氧化生成G,则E为醇,F为醛,G为羧酸,E与F生成的H为酯,化合物H能发生银镜反应,则H为甲酸酯,故E为CH3OH,F为HCHO,G为HCOOH,H为HCOOCH3.A转化得到B与甲醇,B与碱石灰发生信息中脱羧反应得到C,C与二氧化碳、水反应得到苯酚,则C为 ,化合物A苯环上的一硝基取代物有四种,则苯环上含有2个不同的取代基且不是对位位置,则A中含有酯基与酚羟基,可知A为
,化合物A苯环上的一硝基取代物有四种,则苯环上含有2个不同的取代基且不是对位位置,则A中含有酯基与酚羟基,可知A为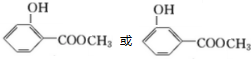 ,B为
,B为 .苯酚与溴水发生取代反应生成D为
.苯酚与溴水发生取代反应生成D为 .
.
(1)化合物D的结构简式为: ;H为HCOOCH3,名称:甲酸甲酯,
;H为HCOOCH3,名称:甲酸甲酯,
故答案为: ;甲酸甲酯;
;甲酸甲酯;
(2)由上述分析可知,则A可能的二种结构简式是: 、
、 ,
,
故答案为: 、
、 ;
;
(3)变化①为醇再碱性条件下发生水解反应,反应条件为氢氧化钠溶液、加热,故答案为:氢氧化钠溶液、加热;
(4)反应③的化学方程:CH3OH+HCOOH$→_{△}^{浓硫酸}$HCOOCH3+H2O,
故答案为:CH3OH+HCOOH$→_{△}^{浓硫酸}$HCOOCH3+H2O.
点评 本题考查有机物的推断,注意对题目信息的理解,结合问题中A的苯环一硝基取代确定A的结构,熟练掌握官能团的性质与转化.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:W>Z | |
| B. | 离子半径:Y2->Z- | |
| C. | 原子序数:Z>Y>X>W | |
| D. | W分别与Y、Z形成的化合物中均只含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
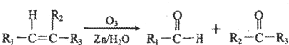
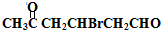 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$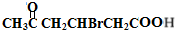 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
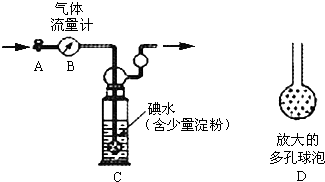 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,不能使蒸发皿中的水分完全蒸干后才停止加热 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b>m+n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com