
【题目】(1)已知某烷烃的键线式为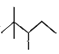 ,
,
① 该烷烃分子式为__________________。
② 用系统命名法命名该烷烃:___________________。
③ 若该烷烃是由烯烃和1molH2加成得到的,则原烯烃的结构有___________种。(不包括立体异构,下同)
④ 该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(2)某有机物X由C、H、O三种元素组成,经测定其相对分子质量为90。取1.8gX在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。则有机物X的分子式为___________。已知有机物X含有一个一COOH,在1H-NMR 谱上观察氢原子给出四种特征峰,强度为3:1:1:l 。则X 的结构简式为_______________。
【答案】C8H182,2,3-三甲基戊烷35C3H6O3
【解析】(1)① 根据该烷烃的键线式,该烷烃的分子式为,故答案为:C8H18;
②根据该烷烃的键线式,该烷烃的结构简式为(CH3)3CCH(CH3)CH2CH3,名称为2,2,3-三甲基戊烷,故答案为:2,2,3-三甲基戊烷;
③ 若该烷烃是由烯烃和1molH2加成得到的,则原烯烃的结构有![]() (·为碳碳双键可能存在的位置),共3种,故答案为:3;
(·为碳碳双键可能存在的位置),共3种,故答案为:3;
④ 该烷烃中含有5种不同环境的氢原子,生成的一氯代烷最多有5种,故答案为:5;
(2)设有机物的分子式为CxHyOz,有机物的质量为1.8g,浓硫酸增重即水的质量为1.08g,碱石灰增重即二氧化碳的质量为2.64g,n(CxHyOz)=![]() =0.02mol,n(H2O)=
=0.02mol,n(H2O)=![]() =0.06mol,n(CO2)=
=0.06mol,n(CO2)=![]() =0.06mol,根据氢原子、碳原子守恒建立关系式:0.02x=0.06,0.02y=0.06×2,
=0.06mol,根据氢原子、碳原子守恒建立关系式:0.02x=0.06,0.02y=0.06×2,
解得x=3,y=6,所以反应物分子式为C3H6Oz,又因为有机物分子量为90,则有机物中O原子数为![]() =3,故推得有机物分子式为C3H6O3;若该有机物含有羧基,且该有机物的核磁共振氢谱图中出现4个吸收峰,说明含有4类氢原子,面积比为3:1:1:1,则这四类氢原子个数之比为3:1:1:1,所以其结构简式为
=3,故推得有机物分子式为C3H6O3;若该有机物含有羧基,且该有机物的核磁共振氢谱图中出现4个吸收峰,说明含有4类氢原子,面积比为3:1:1:1,则这四类氢原子个数之比为3:1:1:1,所以其结构简式为 ,故答案为:C3H6O3;
,故答案为:C3H6O3; 。
。


科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 HO-CH2CH=CHCH2-COOH ,该有机物不可能发生的化学反应是 ( )
A. 水解B. 酯化C. 加成D. 氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+

①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期有18种元素,其相关化合物在化工、医药、材料等领域均有着广泛的应用。请回答下列问题:
(1)基态钙原子核外电子云形状为____________,电子占据的最高能层符号是____________。
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为____________。
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为____________,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是____________。
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维渗杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为____________,中心原子的杂化类型为____________;砷酸酸性弱于硒酸,从分子结构的角度解释原因____________;砷化硼是一种新型材料,或成为最好的热导体,其结构与金刚石相似,已知砷化硼晶胞参数为bpm,则该晶体的密度为____________ g ·cm-3。(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于周期表中的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属元素.此元素可能是( )
A.Si
B.Ge
C.Sn
D.Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二氧化硅既不溶于水也不溶于任何酸
B.二氧化碳通入饱和氯化钙溶液中能生成白色沉淀
C.二氧化碳通入硅酸钠溶液中可以得到硅酸
D.二氧化硅是制造玻璃的主要原料,它不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示。A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6:已知:Mr(R-Cl)-Mr(ROH)=18.5,,Mr表示相对分子质量。
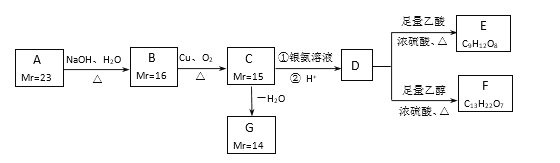
(1)A中含有的官能团符号是_________________。
(2)写出D的分子式____________________________。
(3)下列有关A~G的说法正确的是_____________________。
a.每个A分子中含有官能团的数目为4个 b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物 d.E中含有手性碳原子
(4)写出B生成C的化学方程式______________________________________。
(5)芳香族化合物H与G互为同分异构体, 1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出符合条件的H的结构简式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com