
【题目】某溶液X含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,已知该溶液中各离子物质的量浓度均为
中的几种,已知该溶液中各离子物质的量浓度均为![]() 不考虑水的电离及离子的水解
不考虑水的电离及离子的水解![]() 。为确定该溶液中含有的离子,现进行了如下的操作:
。为确定该溶液中含有的离子,现进行了如下的操作:
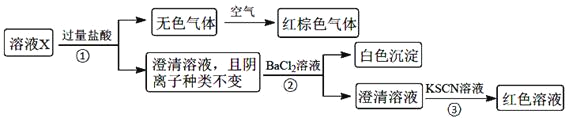
下列说法正确的是![]()
A.无色气体可能是NO和![]() 的混合物
的混合物
B.由步骤![]() 可知,原溶液肯定存在
可知,原溶液肯定存在![]()
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为![]()
【答案】D
【解析】
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,应为Fe2+,则溶液中一定不存在CO32-、OH-、SiO32-,都与Fe2+反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,结合各离子物质的量浓度均为![]() 解答该题。
解答该题。
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有![]() 和还原性离子,应为
和还原性离子,应为![]() ,则溶液中一定不存在
,则溶液中一定不存在![]() 、
、![]() 、
、![]() ,都与
,都与![]() 反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有
反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有![]() ,加入氯化钡生成白色沉淀,则一定含有
,加入氯化钡生成白色沉淀,则一定含有![]() ,加入KSCN溶液呈红色,因
,加入KSCN溶液呈红色,因![]() 被氧化成
被氧化成![]() ,则不能证明X中含有
,则不能证明X中含有![]() ,则溶液中一定存在的离子有
,则溶液中一定存在的离子有![]() 、
、![]() 、
、![]() 、
、![]() ,溶液中各离子物质的量浓度均为
,溶液中各离子物质的量浓度均为![]() ,则还应含有
,则还应含有![]() 、
、![]() 、
、![]() 、
、![]() 中的离子,结合电荷守恒可知,应含有
中的离子,结合电荷守恒可知,应含有![]() ,则:
,则:
A.无色气体只能为NO,故A错误;
B.由以上分析可知不含![]() ,故B错误;
,故B错误;
C.溶液X中所含离子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共5种,故C错误;
,共5种,故C错误;
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,可得到0.01molFe2O3和0.02molMgO,二者质量共为![]() ,故D正确;
,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】下列有机物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
①CH3Cl ② ![]() ③
③ ![]() ④
④![]()
A. ①② B. ②③④ C. ② D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生的可逆反应:X(g)+3Y(g) ![]() 2Z(g),下列说法能充分说明该反应已经达到平衡状态的是( )
2Z(g),下列说法能充分说明该反应已经达到平衡状态的是( )
A. X、Y、Z的浓度均不再发生变化B. X、Y、Z在容器中共存
C. v(正) = v(逆) = 0D. 单位时间内消耗a mol X同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2molL-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8B.19.2C.25.6D.51.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一定量的锌与稀硫酸反应,收集到4.48L氢气(标准状况)。
(1)计算参加反应的锌的质量是多少?__________
(2)若所用稀硫酸的浓度为0.4mol/L,则至少需要硫酸溶液的体积为多少升?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚀刻铜制线路板的蚀刻液种类很多:酸性蚀刻液,如![]() 蚀刻溶液、H2O2-盐酸及CuCl2-盐酸
蚀刻溶液、H2O2-盐酸及CuCl2-盐酸![]() 碱性蚀刻液,如
碱性蚀刻液,如![]() 溶液等。回答下列问题:
溶液等。回答下列问题:
(1)写出下列蚀刻液蚀刻铜的离子方程式。
①FeCl3溶液:_______。
②H2O2-盐酸:_______。
③![]() 溶液:_______
溶液:_______![]() 生成
生成![]() 。
。
(2)利用废![]() 蚀刻液
蚀刻液![]() 含
含![]() 、
、![]() 及
及![]() 制备碱性蚀刻液
制备碱性蚀刻液![]() 溶液和
溶液和![]() 的主要步骤包括:用
的主要步骤包括:用![]() 氧化废蚀刻液,通入氨气
氧化废蚀刻液,通入氨气![]() ,固液分离,用盐酸溶解沉淀和
,固液分离,用盐酸溶解沉淀和![]() 的制备。下列实验装置不能达到实验目的的是_______
的制备。下列实验装置不能达到实验目的的是_______![]() 填字母
填字母![]() 。
。
A. 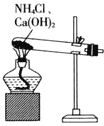 制备
制备![]()
B. 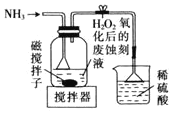 制备
制备![]() 并沉铁
并沉铁
C. 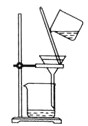 分离
分离![]() 溶液和
溶液和![]() 沉淀
沉淀
D.  将
将![]() 溶液蒸干制备
溶液蒸干制备![]()
(3)常用水合肼![]() 还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
(4)文献报道一种回收蚀刻废液中铜并制取胆矾![]() 的主要工艺流程如下:
的主要工艺流程如下:
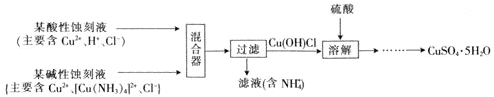
已知:![]() 易与酸反应。
易与酸反应。
![]() 在混合器中,
在混合器中,![]() 的离子方程式为_______。
的离子方程式为_______。
![]() 溶于硫酸的离子方程式为_______。
溶于硫酸的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断不正确的是![]()
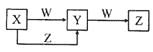
A.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是![]()
B.若图中反应均为氧化还原反应,当W为![]() 时,则X可能是
时,则X可能是![]()
C.若图中反应均为非氧化还原反应,当W为非金属氧化物时,则X可能是NaOH
D.若图中反应均为非氧化还原反应,Y为![]() ,则W可能为一元强酸或一元强碱
,则W可能为一元强酸或一元强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com