
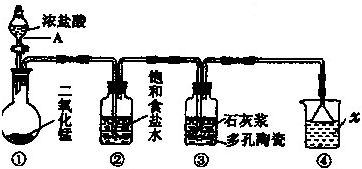


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
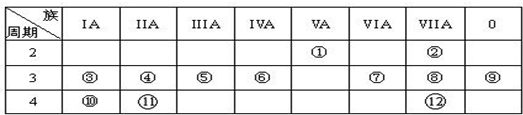
查看答案和解析>>
科目:高中化学 来源: 题型:
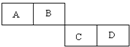 A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4酸性溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
| B、在混有乙酸的乙酸乙酯中加入NaOH溶液可以达到除杂的目的 |
| C、丙烯的结构简式可以表示为CH3CHCH2 |
| D、CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )
如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )| A、反应速率:v(B)<v(A) |
| B、A 容器中X的转化率为80% |
| C、平衡时的压强:2p(A)=p(B) |
| D、平衡时Y的体积分数:A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com