
已知:
①25 ℃、101 kPa时,2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
又已知弱电解质电离吸热。下列结论正确的是( )
A.C的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2014年高二化学苏教版选修2 1.1水的净化与污水处理练习卷(解析版) 题型:填空题
请你参与下列问题的探究:
(1)三峡工程二期已经开始蓄水,为防止三峡库区水被污染,应该采取的措施是________(填序号)。
①清理蓄水库底废弃物
②防止船舶污染
③整治相关河流污染
④治理库区和上游工业污染
(2)载人飞船须建立水的循环体系,以保证宇航员的生活用水并减少飞船的携水量。请将图中各项用箭头连接成水的循环系统(注:氢氧燃料电池反应产生电能,同时生成水)。
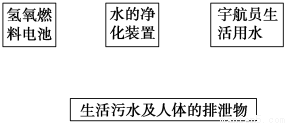
(3)日常生活中我们要科学合理地节约用水,有一个水龙头,每秒漏水2滴,则一天漏水________g(平均每20滴为1 mL,水的密度为1 g·mL-1)。若每个人每日补充水2.5 L,则这些水可以给一个人补充________天水。(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 6影响化学反应速率的因素练习卷(解析版) 题型:选择题
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入H2O(g)使体系压强增大
D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:填空题
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g) CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g) 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是 。
(3)已知:①C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 ______________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:选择题
下列关于反应热的说法正确的是( )
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+O2(g) CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 3燃烧热 能源练习卷(解析版) 题型:选择题
关于能源,以下说法中不正确的是( )
A.煤、石油、天然气等燃料属不可再生能源
B.煤、石油、水煤气可从自然界直接获取,属一级能源
C.太阳能是一级能源、新能源、可再生能源
D.潮汐能来源于月球引力做功
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(解析版) 题型:选择题
用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和反应生成1 mol 水时放热( )
A.55.2 kJB.391 kJC.336 kJD.1.38 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 21电解原理练习卷(解析版) 题型:选择题
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com