
【题目】下列叙述正确的是( )
A.将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L
B.配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL
C.0.270 kg质量分数为10%的CuCl2溶液中Cl﹣的物质的量为0.2 mol
D.80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L
【答案】B
【解析】解:A.令稀释后NaOH的物质的量浓度为c,稀释前后氢氧化钠的物质的量不变,则:0.03L×0.5mol/L=c×0.5L,解得c=0.03mol/L,故A错误;B.设需要浓硫酸的体积为x,根据稀释定律,稀释前后溶质的物质的量不变,则:250mL×1.0mol/L=x×18mol/L,解得x=13.9mL,故B正确;
C.0.270kg质量分数为10%的CuCl2溶液中m(CuCl2)=270g×10%=27g,所以n(CuCl2)= ![]() =0.2mol,则Cl﹣的物质的量为0.4mol,故C错误;
=0.2mol,则Cl﹣的物质的量为0.4mol,故C错误;
D.80 g NaOH溶于1 L水中,溶液的体积不等于水的体积,所以溶液的体积不知道,则不能计算物质的量浓度,故D错误.
故选B.


科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
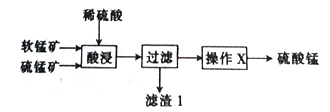
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A. ①②③④ B. ②③ C. ①②④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是 ( )。
3C+5D反应中,表示该反应速率最快的是 ( )。
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 0.3 mol/(L·s)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于道尔顿近代原子论的观点有
A.原子还可由其他更小的微粒构成
B.原子中正电荷是均匀分布在整个原子中
C.原子在化学变化中保持其不可再分性
D.电子在原子核外空间做高速运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C 又称“抗坏血酸”,在人体内有重要的功能.例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
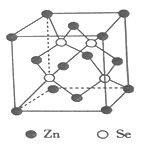
【题目】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为________________。元素锗与砷中,第一电离能较大的是_________(填元素符号,下同),基态原子核外未成对电子数较少的是_______________。
(2)H2SeO3分子中Se原子的杂化形式为____________,H2SeO4的酸性比H2SeO3强,原因是_________。
(3)气态SeO3分子的立体构型为____________,与SeO3互为等电子体的一种离子为_______(填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏伽德罗常数的数值,则晶胞参数ɑ为____________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com