
【题目】(1)有以下六种物质:①乙醇 ②![]() 溶液 ③
溶液 ③![]() 固体 ④液态氯化氢 ⑤纯
固体 ④液态氯化氢 ⑤纯![]() ⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
(2)![]() 和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
(3)配平下列化学方程式,在横线上填写化学计量数。
_________![]() _________
_________![]() _________
_________![]() =_________
=_________![]() _________
_________![]() _________
_________![]()
(4)已知反应:![]() ,当反应生成2.40gBr2时,电子转移的数目为____________。
,当反应生成2.40gBr2时,电子转移的数目为____________。
【答案】②⑥ ③④  2 5 3 6 2 3 0.025 NA
2 5 3 6 2 3 0.025 NA
【解析】
(1)①乙醇不导电为非电解质 ②![]() 溶液可以导电但为混合物 ③
溶液可以导电但为混合物 ③![]() 固体不可以导电为强电解质 ④液态氯化氢不导电但为强电解质 ⑤纯
固体不可以导电为强电解质 ④液态氯化氢不导电但为强电解质 ⑤纯![]() 不导电但为弱电解质 ⑥石墨可以导电但为单质;
不导电但为弱电解质 ⑥石墨可以导电但为单质;
(2)反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)根据元素化合价的变化配平得失电子,然后再依据元素守恒配平整个方程式;
(4)反应中NaBr中溴元素由-1价升高为0价,且只有溴离子化合价升高,化合价升高值=化合价降低值=转移电子数;
(1)根据分析可知能导电的有②⑥;属于强电解质的有③④;
(2)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为 ;
;
(3)反应中锰元素由+7价变为+2价,![]() 中硫元素由+4价变为+6价,所以
中硫元素由+4价变为+6价,所以![]() 和
和![]() 的系数比为2:5,得失电子守恒,再根据元素守恒可得方程式为
的系数比为2:5,得失电子守恒,再根据元素守恒可得方程式为![]() ;
;
(4)反应中NaBr中溴元素由-1价升高为0价,且只有溴离子化合价升高,根据方程式可知生成3mol溴单质时有5molNaBr参与反应,转移电子数为5NA,2.40gBr2的物质的量为![]() ,转移电子为0.015mol×
,转移电子为0.015mol×![]() =0.025mol,即0.025 NA。
=0.025mol,即0.025 NA。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
bB(g)达平衡后,保持温度不变,将容器体积减半,当达到新的平衡时,A的浓度增大为原来的1.8倍,则下列说法错误的是( )
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.恒温恒压时再充入A物质,达到新的平衡时A的质量分数增加了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,海水资源开发和利用是化学研究的一项重要任务。如图是某化工厂对海水资源综合利用的示意图,有关叙述正确的是( )
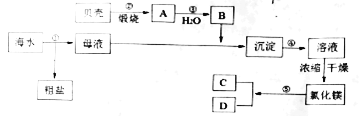
A.上述流程中步骤②~⑤涉及的化学反应包含四种基本反应类型
B.工业上冷却电解无水氯化镁所得的镁蒸气时,选择氩气或氮气
C.步骤④中加入的化学试剂可以为硝酸
D.从步骤④得到的溶液中获得的六水合氯化镁晶体,采用蒸发结晶的方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一瓶放置较长时间的![]() 溶液中取出20mL,向该溶液中逐滴加入
溶液中取出20mL,向该溶液中逐滴加入![]() 盐酸至过量,反应产生的
盐酸至过量,反应产生的![]() 气体的物质的量与加入盐酸的体积关系如图所示(忽略
气体的物质的量与加入盐酸的体积关系如图所示(忽略![]() 溶解和
溶解和![]() 挥发),请回答下列问题:
挥发),请回答下列问题:

(1)O-a段发生反应的离子方程式为______________________,______________________。
(2)O点溶液中所含溶质的物质的量为___________,___________。
(3)原![]() 溶液的物质的量浓度为_____________。
溶液的物质的量浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
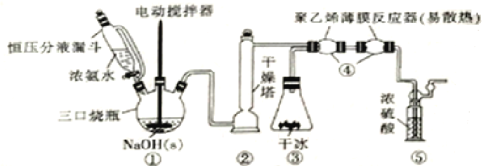
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可代替汽油作为汽车的燃料。已知101 kPa、常温下32 g甲醇完全燃烧放出736.3 kJ的热量,下列能正确表示甲醇标准燃烧热的热化学方程式的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=736.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=736.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-736.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-736.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 472.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学们在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如图所示,回答下列问题:
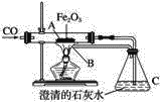
(1)写出用一氧化碳还原氧化铁的化学方程式_________,装置A中看到的现象是________。
(2)在C处看到的现象是_________,发生反应的化学方程式是________,说明反应后有________生成。
(3)本实验设计中,在B处所采取措施的目的是____________,其反应的化学方程式为__________。
(4)在给氧化铁加热时,要先通入一氧化碳气体后加热,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)制取合成气的反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向体积为2 L密闭容器中,按n(H2O)∶n(CH4)=1投料:
a.保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。

①结合图1,写出反应达平衡的过程中的能量变化:______kJ。
②在图1中画出:起始条件相同,保持温度为T2(T2> T1)时, c(CH4)随时间的变化曲线______。
③根据图2判断:
ⅰ. a点所处的状态不是化学平衡状态,理由是_______。
ⅱ. CH4的转化率:c>b,原因是________。
(2)熔融碳酸盐燃料电池的结构示意图如下。

①电池工作时,熔融碳酸盐中CO32-移向________(填“电极A”或“电极B”)
②写出正极上的电极反应:________。
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,外电路通过的电子的物质的量最大为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com