
| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
分析 A、充电时,电源的正极与电池的正极相连,据此回答判断;
B、放电时,原电池的负极发生失电子的氧化反应,据此书写电极反应式;
C、充电时,电解池的阳极发生失电子的氧化反应,据此书写电极反应式;
D、根据电子守恒结合化学方程式进行计算即可.
解答 解:A、总反应式为:XH6+6NiOOHXH6+6NiOOH$?_{充电}^{放电}$X+6Ni(OH)2,储氢合金X为正极,NiOOH/Ni(OH)2为负极,则充电时,电源的正极与电池的正极X相连,故A正确;
B、放电时,原电池的负极Ni(OH)2发生失电子的氧化反应,故B错误;
C、充电时,电解池的阳极发生失电子的氧化反应,即6Ni(OH)2+6OH--6e-═6NiOOH+6H2O,故C正确;
D、电池放电时反应了1molXH6,则转移电子是6mol,电解水化学方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据电子守恒,转移6mol电子时,生成氧气的物质的量是$\frac{3}{2}$×32g/mol=48g,故D错误.
故选AC.
点评 本题考查学生二次电池的工作原理以及电解池和原电池的有关知识,要求学生具有分析和解决问题的能力,难度不大.


科目:高中化学 来源: 题型:多选题
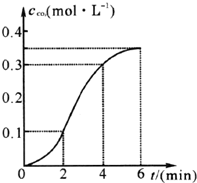 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
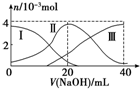 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )| A. | c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) | B. | c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)>c(OH-) | ||
| C. | c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) | D. | c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
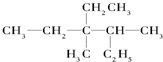 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷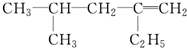
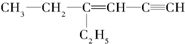 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个查看答案和解析>>
科目:高中化学 来源: 题型:解答题
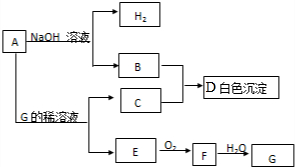
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢的结构式:H-O-O-H | B. | 氮原子的L层电子轨道表示式: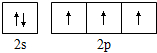 | ||
| C. | CO2的比例模型: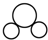 | D. | Cl-的结构示意图: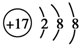 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是极性键形成的极性分子 | |
| B. | 它们的成键方式都只有σ键 | |
| C. | 可燃冰的存在说明甲烷和水分子间能形成氢键 | |
| D. | 它们的分子空间构型都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
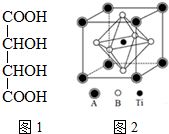 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com