


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
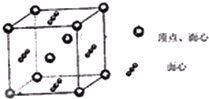 LiN3与NaN3在军事和汽车安全气囊上有重要应用.
LiN3与NaN3在军事和汽车安全气囊上有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | |
| 2 | ③ | ④ | ||||||
| 3 | ② | ⑥ | ⑦ | ⑤ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
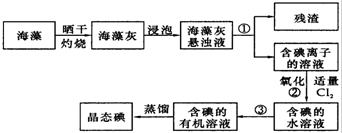
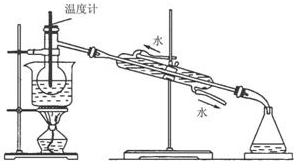
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加适量的盐酸、搅拌 |
| 加适量硫酸铜溶液,搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中不一定含有Fe3+ |
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
| B、用氨水清洗试管壁附着的银镜 |
| C、对苯和硝基苯采用分液的方法分离 |
| D、将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com