
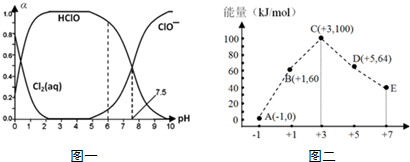
���� ��1��HClO��ɱ��������ClO-ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ϵ�д��ڵ�ƽ����������ˮ��Ӧƽ�⡢������ĵ���ƽ�⡢�������ܽ�ƽ�⣻
��2����Cl2����NaClO2��Һ��ȡClO2��NaClO2��ClԪ�ػ��ϼ���+3�۱�Ϊ+4�ۣ���������ClԪ�ػ��ϼ���0�۱�Ϊ-1�ۣ����ݷ�Ӧ�����������д��ѧ����ʽ����������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2��ͬʱ���ɶ�����̼������Ȼ�����Һʱ��������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�
��3����������Խ��Խ���ȶ���B��������������ԭ��Ӧ����A��D������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��64kJ/mol+2��0kJ/mol��-3��60kJ/mol=-116kJ/mol��
��� �⣺��1��HClO��ɱ��������ClO-ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ͼ֪��pH=6ʱHClO�����ϸߣ�����pH=6ʱƯ��Ч���Ϻã�
���ȵ����ʴ���ƽ���״̬Ϊ������ˮ��Ӧ�����������ƽ�⣬Һ̬��������̬������ƽ��ȣ�����-��ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪCl2��aq��+H2O?HClO+H++Cl-�� HClO?H++ClO-��Cl2��g��?Cl2��aq����
�ʴ�Ϊ��pH=6ʱ��Cl2��aq��+H2O?HClO+H++Cl-��HClO?H++ClO-��Cl2��g��?Cl2��aq����
��2��ClO2��һ���µ�����������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡClO2�����ԭ���غ�͵����غ�д���÷�Ӧ�Ļ�ѧ����Cl2+2NaClO2=2NaCl+2ClO2��
��������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2��ͬʱ���ɶ�����̼����Ӧ�����ӷ���ʽΪC2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O��
����Ȼ�����Һʱ��������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪCl--6e-+3 H2O=6H++ClO3-����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ�
�ʴ�Ϊ��Cl2+2NaClO2�T2NaCl+2ClO2��C2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ����� Cl--6e-+3H2O=6H++ClO3-��
��3��ͼ�������֪������Խ��Խ���ã�+3�۵����������ΪClO2-��
B��A+C������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��64kJ/mol+2��0kJ/mol��-3��60kJ/mol=-116kJ/mol�����Ը��Ȼ�ѧ��Ӧ����ʽΪ3ClO-��aq��=ClO3-��aq��+2Cl-��aq����H=-116kJ/mol��
�ʴ�Ϊ��ClO2-��3ClO-��aq��=2Cl-��aq��+ClO3-��aq����H=-116kJ/mol��
���� ��������Ԫ��Ϊ���忼�鷴Ӧ�ȵļ��㡢���ԭ����������ԭ��Ӧ����ѧƽ���֪ʶ�㣬�ۺ��Խ�ǿ�����ؿ���ѧ��֪ʶ���ü�ͼ������������ѵ��ǵ缫��Ӧʽ����д����3���ⷴӦ�ȵļ��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
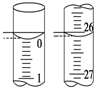 �������ⶨˮ���ܽ����ķ����ǣ�
�������ⶨˮ���ܽ����ķ����ǣ�| �ζ����� | ����Һ�����/mL | 0.1000mol•L-1 Na2S2O3�����/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
| ��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
| ������ | 25.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
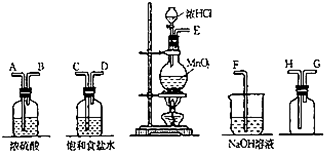 ʵ�������ö���������Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��
ʵ�������ö���������Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L1mol/L�ļ״�ˮ��Һ�к�����ԭ������Ϊ4NA | |
| B�� | 50mL18.4mol/LŨ����������ͭ�ȷ�Ӧ������SO2���ӵ���ĿΪ0.46NA | |
| C�� | ��ӦKIO3+6HI�TKI+3H2O+3I2�У�����3molI2ת�Ƶ��ӵ�����Ϊ5NA | |
| D�� | 12gʯī��C60�Ļ��������������Ϊ12NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
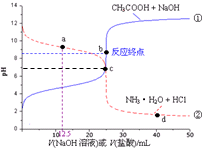
| A�� | a�㣺c��Cl-����c��NH3•H2O����c��NH4+�� | B�� | b�㣺c��OH-��=c��H+��+c��CH3COOH�� | ||
| C�� | c�㣺c��NH4+��=c��CH3COO-�� | D�� | d�㣺c��NH4+����c��Cl-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
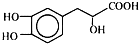
| A�� | ��������C��ȡ��H��һ�ȴ�����4�� | |
| B�� | ��Ni����1 mol������������4 mol H2�ӳ� | |
| C�� | �������ܷ���ȡ������ȥ���к͡������ȷ�Ӧ | |
| D�� | 1 mol��������һ�������������������Ʒ�Ӧ������4 mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
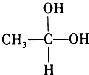 ��CH3-CHO+H2O
��CH3-CHO+H2O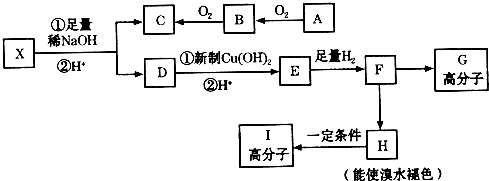
 ��
�� ��
�� ��
��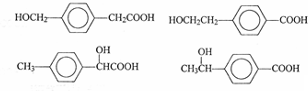 ����һ�֣�
����һ�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
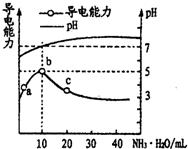
| A�� | HRΪǿ�� | |
| B�� | a��b��c������ʾ��Һ��ˮ�ĵ���̶���ͬ | |
| C�� | b����Һ��c��NH4+����c��R-����c��OH-����c��H+�� | |
| D�� | a��c�������Һ����c��H+����c��OH-��=Kw=l��0��l0-14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ��K1 | 1.8��10-5 | 4.3��10-7 | 3.0��10-8 |
| K2 | -- | 5.6��10-11 | -- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com