
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
【答案】A
【解析】
A.氢氧化镁碱性强于氨水;
B.制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀;
C.得失电子不守恒、电荷不守恒;
D.硝酸具有强氧化性,将亚铁氧化成铁离子;
A.氢氧化镁碱性强于氨水,故A能用来解释相应实验现象;
B.制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀,离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故B不能用来解释相应实验现象;
Fe(OH)3(胶体)+3H+,故B不能用来解释相应实验现象;
C.得失电子不守恒、电荷不守恒,正确的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,故C不能用来解释相应实验现象;
D.硝酸具有强氧化性,其可将亚铁氧化成铁离子,正确的离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故D不能用来解释相应实验现象。
故选A。


科目:高中化学 来源: 题型:
【题目】在初始温度为500 ℃的绝热恒容密闭容器中,充入1 mol HI发生如下反应:2HI(g)![]() H2(g)+I2(g)。能说明该反应达到平衡的是( )
H2(g)+I2(g)。能说明该反应达到平衡的是( )
A. HI的生成速率是I2 消耗速率的2倍
B. 平衡常数不再改变
C. 气体密度不再改变
D. 容器内气体质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3、SiO2等杂质)制取碱式氯化铝的过程如下:
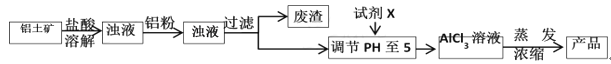
(1)溶解铝土矿需要使用质量分数为15%的盐酸,配制该盐酸所需的玻璃仪器有________
(2)盐酸溶解铝土矿的过程中,发生反应的离子方程式为____________(写一个即可),其目的是__________________________________________________________。
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为__________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,________________________________________________,得出被测液的pH。
(5)实验室利用盐酸与大理石制取CO2的实验装置如图所示:
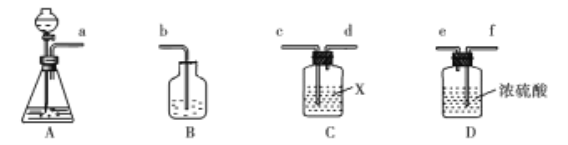
则各装置中导管从左到右的连接顺序为_________,装置C中盛放的试剂X为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. 常温下,HSO3-的水解能力强于其电离能力
B. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C. Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com